大鼠骨骼肌细胞培养实验步骤
骨骼肌是一种横纹肌,通常是通过肌腱固定到骨骼上,其伸缩可以带动骨骼的移动,促进机体运动。肌细胞呈纤维状,不分支,有明显横纹,核很多,且都位于细胞膜下方。肌细胞内有许多沿细胞长轴平行排列的细丝状肌原纤维,每一肌原纤维都有相间排列的粗肌丝及细肌丝。肌纤维收缩并不是肌纤维中肌丝本身的缩短或卷曲,而是细肌丝在粗肌丝之间滑行的结果, 肌丝滑行使肌节长度缩短,肌原纤维缩短表现为肌纤维收缩。
体外培养大鼠骨骼肌细胞,为临床肌肉损伤的治疗提供理论依据,本文主要介绍大鼠骨骼肌细胞培养的具体流程以及注意事项,供正在做这类实验的科研朋友参考学习。
一、大鼠骨骼肌细胞培养实验前准备
实验开始前,将眼科剪刀、眼科镊子、培养皿,15ml 离心管、移液管、移液枪、枪头等放入无菌超净工作台,以紫外线照射 30min。
按照含 0.2%的 XI 胶原酶、0.2%的中性蛋白酶、0.1%的胶原酶进行配制消化液,用 0.22 微米的 PES 微孔滤膜进行过滤除菌,置于 50 毫升离心管中,可直接用于组织消化。瓶口消毒后室温待用。
取出无菌培养皿,分别作好标记,吸取适量 PBS 置于相应标记的培养皿中。
无菌条件下,准备好各种大小的眼科剪刀、止血钳、眼科镊子和手术刀。将断颈处死后浸泡于体积分数为 75%乙醇的 SD 大鼠仰卧在超净台内的干净培养皿上。
二、骨骼肌提取
1、眼科剪刀剪开大鼠后肢皮肤,暴露腿部肌肉,用手术刀小心割取后肢大腿肌肉,同样方法分离另一后肢大腿肌肉。小心剪取表面无附着膜和脂肪组织的肌肉,置于装有 PBS 的无菌培养皿中。
2、吸取适量消化液于相应标记的培养皿中。
3、将剪取的骨骼肌在无菌 PBS 浸泡清洗,去除脂肪组织后放置于含消化液的培养皿中,采用眼科剪刀剪碎骨骼肌组织,成 1 平方毫米不规则碎片。
4、轻轻摇匀,室温静置消化 30 分钟
5、收集组织悬液于 50 毫升离心管中,用消化液反复冲洗培养皿,直至将全部组织块收集到离心管内。
6、轻轻吹打混匀组织块悬浮液。
7、配平离心:每分钟 1000 转,室温离心十分钟。
三、骨骼肌悬液制备及培养
离心后小心去除上清,不要吸到底部的组织块沉淀,用含 20%胎牛血清的 DMEM 培养基重悬,轻轻吹打混匀,制成悬液,均匀转移至六孔板中,轻轻摇匀,标记时间后放于 37 ℃、体积分数为 5%的 CO2 饱和湿度培养箱中培养。
本次实验采用差速贴壁法去除成纤维细胞,37 ℃培养 1 小时 后,吸取上清液置于另一孔中继续培养,每隔一小时转移一次,转移 3-4 次。4 天后换液, 以后每天换液 1 次,直到增殖达到融合。
四、细胞观察及鉴定
差速培养后,细胞 24 小时后开始贴壁,96 小时后完全贴壁,倒置显微镜下每天观察细胞生长及形态特征,传代培养纯化至 P3 代用于后续试验。
采用 HE 染色和a-actin 染色进行骨骼肌细胞鉴定。
结果表明:本实验所用的消化液以及差速贴壁法可分离培养出纯度高、活力旺盛的骨骼肌细胞。
五、大鼠骨骼肌细胞培养注意事项
1、消化液的制备及消化时间
合适的消化液以及消化时间的把握, 是实验取材的关键:
合适的消化液利于骨骼肌细胞从基膜中释放出来。酶作用时间不足则获得细胞较少,作用时间过长则可致细胞受损、生长状态不佳。
2、肌肉组织要尽可能剔除表面的膜和脂肪组织:
肌肉组织表明的膜和脂肪组织去除利于后续细胞的纯化,减少传代次数,获得纯度高的骨骼肌细胞。
3、纤维细胞的去除:
本实验采用差速贴壁法去除成纤维细胞,37 ℃培养 1 小时后移至另一孔进行培养,转移两次,有效去除骨骼肌细胞中的成纤维细胞。
-
论文打印要求是什么,单面还是双面? 132349
-
ieee论文什么水平,含金量如何? 71502
-
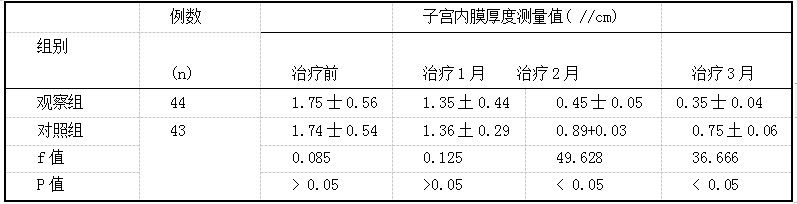
左炔诺孕酮不同给药途径对患者子宫内膜增生症的临床疗效评价 2019.10.30 15:05
-
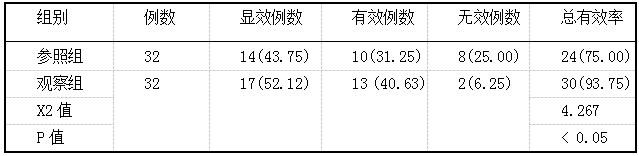
胸腺肽与恩替卡韦联用对患者原发性肝癌的临床疗效及其对预后的影响 2019.10.30 14:47
-
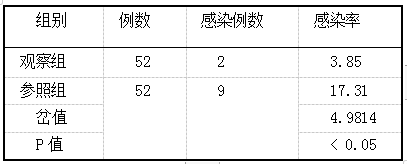
甲硝唑片官腔置入与左氧氟沙星口服对人工流产患者术后抗感染的临床疗效评价 2019.10.30 14:28
-
瑞舒伐他汀与常规降压药物联用对反勺型高血压患者降压疗效的影响 2019.10.30 11:35
-
 DNA的琼脂糖凝胶电泳实验原理和步骤
DNA的琼脂糖凝胶电泳实验原理和步骤 -
提取RNA及用DEPC去除RNase的实验经验
-
 医学生物学电子显微镜图谱
医学生物学电子显微镜图谱 -
 如何使用 NCBI 查找基因序列、mRNA和Promoter
如何使用 NCBI 查找基因序列、mRNA和Promoter