改善急性缺血性脑卒中侧支循环的临床意义及研究进展
改善急性缺血性脑卒中侧支循环的临床意义及研究进展
陈大伟,宋琛,石进
关键词:卒中;侧支循环;血栓溶解疗法;华法林;阿司匹林;支架
脑动脉侧支循环是指当大脑供血动脉狭窄或闭塞时,血流通过其他血管(侧支或新形成的血管吻合)到达缺血区,从而使缺血组织得到不同程度的灌注代偿。近期的急性缺血性脑卒中(acute ischemic stroke,AIS)静脉溶栓和血管内治疗临床研究发现,侧支循环状态是责任血管成功再通和缺血脑组织成功再灌注的关键,使我们对脑侧支循环的临床意义有了深入认识[3-4]。其次,一些基础研究阐明了脑侧支循环开放的生理机制,为改善脑侧支循环提供理论基础,为AIS治疗开辟新的道路[5-6]。另外,随着一系列改善脑侧支循环的药物和非药物方法出现和相关临床试验的展开,改善脑侧支循环必将成为AIS潜在而重要的辅助治疗方式‘明。
1 脑侧支循环对AIS的临床意义
虽然治疗AIS的新方法不断出现,但大量文献证实,无论采用哪种治疗方式,脑侧支循环状态均是决定AIS患者临床预后的一个主要因素。
对于AIS静脉溶栓治疗,一系列研究表明,治疗前具有良好侧支循环患者发生脑梗死面积较小、临床预后更好卧1。一项AIS动脉溶栓研究显示,对于颅内或颈动脉严重狭窄或闭塞所致AIS患者,数字减影血管造影显示,软脑膜侧支代偿较好患者接受动脉溶栓后有更好的临床疗效口3。有研究对222例AIS患者进行动脉溶栓治疗,结果证实,治疗前侧支循环越好,治疗后其责任血管再通率越高,并且血管再通后,侧支循环越差患者更容易发生梗死体积扩大。Mer-CI,m等非支架机械取栓为AIS治疗开辟了新的道路,但2013年3项多中心前瞻性随机对照研究均未发现机械取栓的临床获益。随后的亚组分析表明,侧支循环状态是决定血管内治疗临床结果的一个关键因素,即较高侧支循环评分患者闭塞动脉再通率和下游血管床再灌注比例高,而对于颈内动脉或大脑中动脉Ml段闭塞患者,侧支循环差患者临床预后均不佳[3-4]。美国食品与药物管理局于2012年又批准了Solitaire rM和TrevoTM支架取栓装置,这是AIS血管内治疗又一个巨大进步。2项随机对照试验比较了支架取栓装置和传统Merci'r”设备的临床效果。虽然研究表明,新的支架取栓设备在成功开通闭塞血管和减少症状性出血方面明显优于传统非支架取栓设备,但较高侧支循环评分仍决定较好的脑组织再灌注和神经功能缺损的恢复。吸取以往经验教训,2015年5个多中心随机对照试验同时声明,在排除大的脑梗死(Alberta卒中项目早期CT评分<5~7分)和差的侧支循环患者后,血管内治疗(联合或不联合静脉溶栓)对AIS和大动脉闭塞效果明显优于单独静脉溶栓治疗‘”。14。另一项大的颅内动脉近段闭塞患者前瞻性队列研究表明,在未接受静脉溶栓和血管内治疗患者中,强大的软脑膜侧支循环也是预测良好远期临床结果的独立指标。总之,良好的侧支循环意味着更大范围的半暗带和更小的梗死体积及更好的临床预后。在接受静脉溶栓的AIS患者中,Willis环不完整患者发生症状性颅内出血比例是Willis环完整患者的3倍多;而在接受血管内治疗患者中,较差侧支循环状态患者更容易发生脑出血转化。另外,差的侧支循环状态也通常预示再灌注治疗后更容易发生恶性脑梗死。
无论是静脉溶栓还是血管内治疗,缩短再灌注治疗时间是取得良好临床效果的关键。近年来研究发现,部分AIS患者虽然超过了治疗时间窗,仍可从血管内治疗中获益,提示侧支循环状态是影响治疗时间窗的关键因素‘胡。新的DAWN试验显示,对于具有良好脑侧支循环(临床症状与MRI弥散加权成像失匹配)的AIS患者,在发病后6~24 h,血管内治疗联合内科治疗对减少临床致残率和改善预后仍优于单独内科治疗[17]。因此,一些学者认为,应该根据脑侧支循环状态决定血管内治疗的时间窗和选择合适的患者及指导AIS的治疗:(1)无侧支循环患者,除非在症状发生后th内接受治疗,否则不会从血管内治疗中获益;(2)具有较差侧支循环患者,仅当症状发生后5h内接受治疗,并获得再灌注,才会从血管内治疗中获益;(3)具有良好侧支循环患者,即使症状发生>6 h,仍可能从血管内治疗中获益‘18]。
目前仅有一项研究比较了早期和晚期侧支循环状态对AIS临床预后的影响。Yeo等[19]对209例大脑中动脉区AIS患者进行静脉溶栓治疗,采用CT血管成像对“基础侧支循环状态”和“迟发侧支循环状态(ld后)”进行评估,结果显示,早期侧支循环差但第2天侧支循环明显建立者取得好的临床结果比例低,颅内出血比例高,而对于早期侧支循环好的患者,迟发侧支循环状态不会影响患者临床预后。上述研究提示,早期侧支循环状态决定AIS患者的临床预后,但该研究结果的可靠性还需进一步证实。除了AIS的治疗,近期的2个大型卒中预防试验:华法林和阿司匹林治疗症状性颅内狭窄疾病,支架和强化药物治疗预防颅内动脉狭窄患者脑卒中复发研究显示,侧支循环的代偿程度还是症状性颅内动脉狭窄供血区发生脑卒中事件的独立预测因素。
2脑侧支循环的解剖结构
目前人类脑动脉侧支循环通常分为三级。一级侧支指Willis环;二级侧支指通过眼动脉、软脑膜吻合支以及其他相对较小的侧支与侧支吻合之间实现的血流代偿,可按侧支来源再细分为颅外一颅内侧支和颅内侧支;三级侧支属于新生血管。上述分类方法大的问题在于对改善侧支循环治疗无指导意义,因此我们建议,固有的侧支、潜在的侧支及新生血管的侧支分类法Ⅲ。(1)固有的侧支是指人体解剖结构上已经存在且已发挥功能的代偿途径,除Willis环外,还包括颈内动脉一脉络膜前动脉一脉络膜后动脉一大脑后动脉代偿途径,连接颈内动脉与椎基底动脉系统的胚胎大脑后动脉、永存三叉动脉等;(2)潜在的侧支是指人体解剖结构上已经存在但正常情况下不起作用,当发生主供血管缺血后可以转变为有效代偿途径,主要指眼动脉及软脑膜吻合支等;(3)新生血管的侧支。虽然固有的侧支循环是重要的代偿途径,可迅速使左右大脑半球及前后循环的血流相互沟通,但Willis环参与侧支循环的血管变异很大,已往报道仅有50%人群具有完整的Willis环,且一些完整的Willis环前、后交通动脉或其他结构发育不良,对于这些存在Willis环缺陷的AIS患者,固有的侧支循环代偿明显受限‘明。新生血管的侧支循环通常在缺血后数天才能完全建立血流代偿,对AIS患者的代偿意义尚不明确【幻。潜在的侧支循环是主要大动脉末端的小动脉和微动脉间吻合,可允许相邻动脉区域间血流互通,是急性动脉闭塞时发挥侧支循环代偿主要途径,因此它已成为增强AIS患者侧支循环代偿的主要靶点。
3脑侧支循环形成和调节的机制
血管生长的主要模式可分为血管生成和动脉生成‘明。血管生成是指从已存在血管上长出新生毛细血管网的过程,主要由缺氧触发,缺氧所产生低氧诱导因子1和其下游的各种转化因子参与了血管形成,血管生成通常发生于脑卒中晚期或恢复期,主要参与脑卒中后缺血半暗带脑组织重构和功能恢复,但对改善AIS侧支循环作用有限。动脉生成是指将已存在血管转化为具有功能的侧支循环的过程。动脉生成主要由血流剪切力触发,当大脑动脉严重狭窄或闭塞时,其远端压力明显下降,导致已存在的潜在侧支循环两端形成压力梯度,进而促进侧支血管血流速度增快和血管壁血流剪切力增加。一方面,血流剪切力可诱导血管内皮细胞激活和NO生成,促进动脉生成和加快侧支血流;另一方面,血流剪切力可诱导单核、巨噬细胞侵入和炎性反应,产生多种细胞因子和生长因子,促进细胞外基质降解和促进血管内皮细胞和平滑肌细胞增生,扩大侧支内径和调整侧支的血流速度。
动脉生成一般发生于脑卒中早期,是功能侧支循环形成的主要途径,并处于动态过程,早期可加快侧支循环血流速度,当侧支血管经过重构内径扩大后,侧支血流速度相应下降口。71。
4改善脑侧支循环策略的研究进展
一些全身因素可以影响和削弱侧支循环开放和形成,并导致梗死范围扩大,这些因素包括:脱水、高温、高尿酸血症、高血糖、高血液黏度、感染、呼吸衰竭、心功能衰竭、肾功能不全、电解质紊乱和高剂量降压药物等,及时干预并纠正上述高危因素能够大大降低侧支循环衰竭的风险。此外,一些改善侧支循环、增加脑血流量药物和非药物干预方案正被开发并尝试应用于AIS治疗。
4.1药物策略
4.1.1 扩容 利用血浆扩容制剂对AIS治疗早开始于20世纪60年代,其中右旋糖酐和羟乙基淀粉临床试验均已证明不能改善AIS患者的临床预后6-7]。有研究表明,人血白蛋白可以通过多种功能改善脑血流量。有研究证实,在基础侧支循环差的大鼠模型,人血白蛋白能够增强局部缺血组织侧支循环灌注。随着高剂量人血白蛋白静脉注射治疗(2g/kg)被临床试验证明是安全、有效的,近期一个多中心3期临床对照试验被启动用于调查人血白蛋白静脉注射对AIS的治疗作用。治疗组采用静脉注射25%高剂量人血白蛋白,对照组采用静脉注射生理盐水,观察3个月致残率,但该试验因未发现人血白蛋白能改善AIS患者3个月的临床预后而提前终止。更深入分析发现下面问题:(1)人血白蛋白治疗组好的临床结果百分率一直稳定在44%~45%,而生理盐水对照组好的临床结果百分率从开始的31%逐渐上升至试验截止期的44%;(2)同时接受组织型纤溶酶原激活剂( tissue plasminogen activator,t-PA)静脉溶栓患者百分率也从开始的75%升至95%;(3) t-PA静脉溶栓本身可以明显改善患者临床预后,但亚组分析显示,生理盐水对照组接受t-PA静脉溶栓患者获得好的临床结果的相对比值(OR一2.8)明显高于人血白蛋白治疗组的相对比值(OR一1.7)。
上述结果提示,t-PA静脉溶栓和人血白蛋白静脉注射对AIS患者临床预后可联合产生“天花板”效应,人血白蛋白静脉注射的单独作用很难分离出来,因未接受t-PA静脉溶栓患者有限,无法进一步分析人血白蛋白静脉注射在该人群中的效应。另外,动物模型显示,人血白蛋白静脉注射改善侧支循环的作用仅存在于基础侧支循环差而非侧支循环正常大鼠,因此人血白蛋白对基础侧支循环差的AIS患者临床预后的影响值得进一步研究[16]。美国2018年版AIS的早期管理指南未推荐扩容制剂应用于AIS治疗。而我国2014年版AIS诊治指南仅推荐其可用于低血压或低灌注所致的分水岭样梗死[21]。
4.1.2扩张血管 虽然人们一直认为,脑动脉扩张剂能通过增加侧支循环而改善缺血脑组织的供血,但一些临床试验发现,脑血管扩张剂对AIS患者神经系统功能改善的结果并不一致[6-7]。因此,美国2018年版AIS的早期管理指南和我国2014年版AIS诊治指南均未推荐其应用于AIS治疗[20-21]。已有研究证实,缺血脑组织动脉是扩张的,给予血管扩张剂可能仅扩张正常脑组织血管,进而使缺血脑组织发生盗血而导致缺血加重,因此,能够找到一种仅扩张侧支动脉的药物尤为重要‘6]。血管内皮细胞来源的NO被认为参与了动脉生成和血管扩张。动脉结扎大鼠模型实验显示,NO合酶基因敲除大鼠侧支循环形成和血流介导的动脉扩张明显少于正常大鼠,提示NO合酶在维持血管闭塞疾病的侧支循环建立上有重要作用。近年来,Terpolilli等一系列动物实验表明,吸人性NO有望成为改善AIS患者侧支循环的一个新方法,这些实验包括:(1)在正常脑组织,吸人性NO仅能扩张软脑膜静脉,而不能影响动脉管径和脑血流量;(2)吸人性NO诱导的软脑膜静脉扩张能够被局部注入的鸟苷酰环化酶抑制,提示吸人性NO能够直接作用于局部脑组织;(3)在双侧颈动脉结扎所诱发的脑灌注下降大鼠模型中,与正常脑组织不同,吸人性NO不仅能扩张软脑膜静脉,还能扩张软脑膜动脉,(4)在大脑中动脉闭塞大鼠模型中,吸人性NO可以导致缺血半暗带小动脉和小静脉的明显扩张,而对梗死核心区和正常脑组织无影响;(5)在永久性大脑中动脉闭塞大鼠模型中,吸人性NO能够减少脑梗死体积;(6)在永久性大脑中动脉闭塞山羊模型中,大脑中动脉闭塞后2h开始给予吸人NO,吸人性NO能够选择性提高缺血半暗带脑血流量,并减少50%缺血半暗带体积,进一步证实吸人性NO能选择性扩张低灌注脑组织血管。虽然还没有关于吸人性NO治疗AIS的临床评价,但吸人性NO已经开始应用于新生儿低氧性呼吸衰竭和肺动脉高压,成人肺损伤和呼吸窘迫综合征、肺动脉高压、肺移植及儿童镰状细胞危象等疾病的临床治疗。
4.1.3升高血压AIS患者脑缺血部位的血管自主调节机制受损导致平均动脉压对脑血流的影响从曲线关系变为线性关系,因此,血压升高可能通过增加侧支循环血流量改善脑组织供血[6-7]。在大脑中动脉闭塞动物模型中,血管紧张素或苯肾上腺素诱导的血压升高(平均动脉压升高30%k60%)能够减少脑梗死体积和增加软脑膜侧支循环血流量。虽然一些临床前期试验表明,药物诱导的轻度高血压可以改善AIS患者神经系统功能缺损,并具有相对安全性,但目前还没有大的随机对照临床试验证实该措施的有效性,同时也没有临床试验表明,药物诱导的血压升高是通过侧支循环增加缺血脑组织的血流量邸]。另外,升高血压具体的佳治疗时机及长度仍不确定,用药基线血压值及目标血药值也不统一,治疗基线收缩压120~150 mm Hg(l mm Hg-0. 133kPa),多数试验目标是维持收缩压>160 mm Hg或平均动脉压升高lO%~20%;血压升高水平与脑血流增加量的关系也未知[。因此,美国2018年版AIS早期管理指南对该措施做了较低级别的推荐,且未明确具体药物。
4.1.4他汀类药物他汀类药物对脑卒中一级及二级预防都起重要作用,强化降低胆固醇预防脑卒中研究证实,他汀类药物可显著降低脑卒中复发率,改善患者预后‘2]。他汀类药物除可调脂、稳定动脉粥样硬化斑块外,缺血性脑卒中动物模型还显示,它具有上调内皮细胞NO合酶表达、促进侧支循环和增加脑血流及减少梗死体积和促进神经功能恢复等作用。脑血管闭塞的AIS患者血管内治疗前造影表明,脑卒中发作前就使用他汀类药物患者较未使用他汀类药物患者有更高的侧支循环评分、更小的梗死体积和更好的临床预后。另一个大的临床研究证实,心源性脑卒中患者发病前服用他汀类药物是良好侧支循环状态的独立预测因素[22]。
4.1.5尤瑞克林尤瑞克林是从人尿中分离精制的高纯度激肽原酶。激肽原酶水解体内的激肽原,产生激肽,激肽作用于血管内皮细胞上的激肽受体后,通过第二信使转导途径生成NO和前列环素,在机体内产生广泛的生物学效应,如舒张血管、促进血管新生、抑制细胞凋亡和抑制氧化应激等。动物实验研究表明,尤瑞克林能舒张缺血区皮质软脑膜血管,提高缺血侧脑血流储备能力,改善缺血半暗带血液灌注,逆转缺血半暗带脑细胞缺血坏死,进而减轻脑缺血面积,改善神经功能缺损症状[21]。临床研究也表明,尤瑞克林可促进侧支循环,增加缺血区脑血流灌注,减少神经元死亡,改善患者临床预后。
4.1.6 丁苯酞3正丁基苯酞是一个光学异构体家族,包括右旋和左旋3一正丁基苯酞,丁苯酞为消旋-3-正丁基苯酞,与芹菜籽中提取的左旋芹菜甲素结构相同,为其人工合成的消旋体,是我国自主研发化学合成的一类新药‘23]。动物实验显示,丁苯酞通过抗血小板聚集、保护线粒体功能、减少神经元凋亡、抑制氧化应激、促进神经再生等多种机制,减少AIS体积和减轻神经功能缺损程度”]。丁苯酞还可以改善脑缺血区侧支循环,促进缺血区血管新生,增加缺血区脑血流[21]。丁苯酞能显著增加大脑中动脉闭塞和蛛网膜下腔出血大鼠模型纹状体区脑血流量及局灶性脑缺血大鼠软脑膜微动脉管径及血流速度。丁苯酞可活化血管内皮细胞功能,促进NO和前列环素产生,两者对血管扩张和侧支循环建立具有重要作用。多个评价丁苯酞口服胶囊对AIS治疗作用的多中心、随机、双盲、安慰剂对照试验显示,丁苯酞可以减轻AIS患者神经功能缺损和改善生活能力评分,且安全性好[21]。另一项大型随机对照试验表明,丁苯酞注射液和丁苯酞胶囊序贯治疗对AIS患者神经功能改善明显优于奥扎格雷和阿司匹林联合治疗,且无严重不良反应[21]。近期临床试验证实,丁苯酞能够显著提高AIS患者侧支循环及改善神经功能缺损评分。我国2014年版AIS诊治指南已推荐丁苯酞作为AIS治疗用药[21]。
4.2非药物策略 用于增强AIS患者脑侧支循环的非药物方法包括:体外反搏、部分主动脉阻断、蝶腭神经节刺激术、经颅激光疗法等。体外反搏是将3对气囊分别绑在患者小腿、大腿及臀部,系统启动是由患者心电导联触发的,在心脏舒张早期向气囊充入气体以促进静脉血回流,在心脏收缩期前放气,减少心脏后负荷,提高心输出量。部分主动脉阻断是将主动脉球囊装置放置于腹主动脉,通过充气部分阻断腹主动脉管腔,使阻塞点以上主动脉血流增加,进而增强脑血流量。蝶腭神经节刺激术是通过刺激蝶腭神经节激活支配颅内血管的副交感神经,导致血管舒张而增加脑血流量。经颅激光疗法是使用近红外线激光将能量经颅骨送至颅内的一种无创技术,可通过增加颅内NO水平而增加脑血流量口3。虽然这些增强脑血流的非药物方法已进入临床应用,且显示一定安全性,但仍有待于大规模随机双盲对照试验证明其疗效,因此,美国2018年版AIS早期管理指南对这些非药物方法做了低级别推荐,且仅能应用于临床试验[20]。
5小结
综上所述,无论接受静脉溶栓还是血管内治疗的AIS患者,以及无法进行血管开通治疗的患者,良好的侧支循环状态是预测血管再通、脑组织再灌注、小梗死面积及更好临床预后的一个主要因素。血流剪切力所诱导的潜在侧支循环开放和重构是建立有效侧支循环的主要途径,也是增强侧支循环的治疗靶点。尽管目前增强侧支循环的药物和非药物方法疗效仍然不明确,还有待于大型临床试验进一步验证,也尚未得到国内外AIS治疗指南的较强推荐,但作为AIS的一种重要辅助治疗方式,建立有效的侧支循环仍对我们有着巨大吸引力。
参考文献
[1]史文倩,石进.脑动脉侧支循环代偿分型与评价[J].内科急危重症杂志,2014, 20(3):148-150. D()I: 10. 11768/nkjwzzzz20140302.
[2] 中国卒中学会脑血流与代谢分会.缺血性卒中脑侧支循环评估与干预中国指南(2017) [J].中华内科杂志,2017,56(6):460-471. D01:10. 3760/cma.j. issn. 0587-1426. 2017. 06.016.
[3] Bang OY,Goyal M,Liebeskind DS. Collateral circulation in is-chemic stroke: assessment tools and therapeutic strategies[J]. Stroke, 2015, 46( 11):3302-3309. DOI: 10. 1161/STROKEAHA. 115. 010508.
[4] Ginsberg MD. Expanding the concept of neuroprotection foracute ischemic stroke:the pivotal roles of reperfusion and thecollateraI circulation [J]. Prog Neurobiol, 2016, 145-146: 4677. DOI:10. 1016/j. pneurobio. 2016. 09. 002.
[5] Iwasawa E,Ichijo M,Ishibashi S,et al. Acute development ofcollateral circulation and therapeutic prospects in ischemicstroke[Jl. Neural Regen Res, 2016, 11(3):368-371. D01:10. 4103/1673-5374. 179033.
[6] Liu J,Wang Y,Akamatsu Y,et al. Vascular remodeling afterischemic stroke: mechanisms and therapeutic potentials[J].Prog Neurobi01,2014 ,115: 138-156. DOI: 10. 1016/j. pneurobio. 2013. 11. 004.
[7] Nishijima Y, Akamat-su Y, Weinstein PR, et al.Collaterals:implications in cerebral ischemic diseases and therapeutic interventions[Jl. Brain Res, 2015, 1623: 18-29. D()I:10.1016/j. brainres. 2015. 03. 006.
[8] Tomsick TA, Yeatts SD, Liebeskind DS, et al. Endovascularrevascularization results in IMSⅢ:intracranial ICA and Mlocclusions[Jl.J Neurointerv Surg, 2015,7(11): 795-802.DOI:10. 1136/neurintsurg-2014-011318.
[9] 中国卒中学会,中国卒中学会神经介入分会,中华预防医学会卒中预防与控制专业委员会介入学组,急性缺血性卒中血管内治疗中国指南2015 [J].中国卒中杂志,2015,10(7):590-606. DOI:10. 3969/j. issn. 167 3-5765. 2015. 07. 011.
[10] Berkhemer OA,Fransen PS,Beumer D,et al.A randomizedtrial of intraarterial treatment for acute ischemic stroke[Jl.NEngl J Med, 2015, 372 (1): 11-20. DOI: 10. 1056/NEJ-Moa14115 87.
[11] Goyal M, Demchuk AM,Menon BK, et al.Randomized assessment of rapid endovascular treatment of ischemic stroke[J].N Engl J Med, 2015, 372( 11): 1019-1030. DOI: 10.1056/NEJMoa141490s.
[12] Saver JL,Goyal M,Bonafe A,et al. Stent-retriever thrombectomy after intravenous 't-PA vs. t-PA alone in stroke[Jl.NEngl J Med,2015,372( 24):2285-2295. DOI: 10. 1056/NEJMoa1415061.
[13] Campbel BC, Mit chel PJ, Kleinig TJ, et al.Endovasculartherapy for ischemic stroke with perfusion-imaging selection[Jl.N Engl J Med, 2015, 372( 11): 1009-1018. DOI: 10.1056/NEJMoa1414792.
[14] Jovin TG,Chamorro A,Cobo E,et al. Thrombectomy within8 hours after symptom onset in ischemic stroke[Jl.N Engl JMed, 2015, 372( 24):2296-2306. DOI: 10. 1056/NEJ-Moa1503780.
[15] Rocha M,Jovin TG. Fast versus slow progressors of infarctgrowth in large vessel occlusion stroke: clinical and researchimplications[Jl. Stroke, 2017, 48(9):2621-2627. DOI: 10.1161/STROKEAHA. 117. 017673.
[16]彭斌,崔丽英.重视对脑侧支循环的深入研究[J].中华神经科杂志,2018, 51(1): 4-6. DOI: 10. 3T60/cma.j. issn. 10067876. 2018. 01. 002.
[17] Nogueira RG,Jadhav AP, Haussen DC,et aI. Thrombectomy6 t0 24 hours after stroke with a mismatch between deficitand infarct[Jl.N Engl J Med, 2018, 378 (1): 11-21. D()I:10.1056/NEJMoa1706442.
[18] Raymond SB,Schaefer PW. Imaging brain collaterals:quanti-fication,scoring,and potential significance[Jl. Top Magn Re-son Imaging, 2017, 26(2):67-75. D()I: 10. 1097/RMR.0000000000000123.
[19] Yeo LL,Paliwal P,I.ow AF,et al. How tempora! evolution ofintracranial collaterals in acute stroke affects clinical outcomes[J]. Neurology, 2016, 86(5):434-441. D()I: 10. 1212/WNL. 0000000000002331.
[20] Powers WJ, Rabinstein AA, Ackerson T, et al. 2018 guidelines for the early management of patients with acute ischemicstroke:a guideline for healthcare professionals from theAmerican Heart Association/American Stroke Association[Jl. Stroke, 2018, 49(3):e46-el10. DOI: 10. 1161/STR.0000000000000158.
[21] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257. DOI: 10. 3760/cma.j. issn.1006-7876. 2015. 04. 002.
[22] Lee MJ,Bang OY,Kim SJ,et al. Role of .statin in atrial fibril-lation-related stroke:an angiographic study for collateral flowEJ]. Cerebrovase Dis, 2014, 37(2):77-84. DOI: 10. 1159/000356114.
[23] Abdoulaye IA,Guo YJ.A Review of recent advances in neu-roprotective potential of 3-N-butylphthalide and its deriva-tivesEJl. Biomed Res Int, 2016, 5012341. DOI: 10. 1155/2016/5012341.
[24]吴玉芙,刘晓红,郭伟成,等,丁苯酞注射液治疗急性前循环脑梗死的疗效观察[J].中国卒中杂志,2017,12( 12):11111114. DOI:10. 3969/j. issn. 1673-5765. 2017. 12. 008.
-
论文打印要求是什么,单面还是双面? 132544
-
ieee论文什么水平,含金量如何? 71593
-
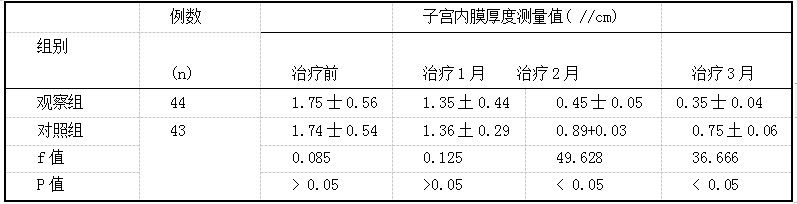
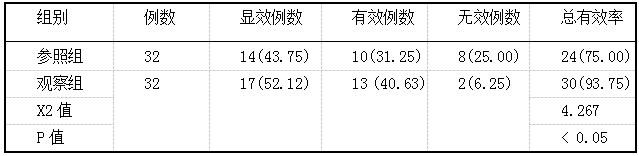
左炔诺孕酮不同给药途径对患者子宫内膜增生症的临床疗效评价 2019.10.30 15:05
-
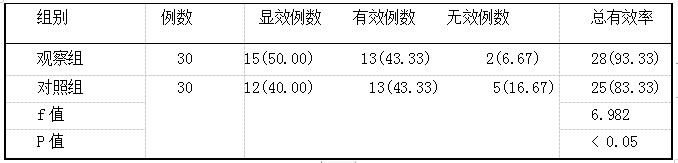
胸腺肽与恩替卡韦联用对患者原发性肝癌的临床疗效及其对预后的影响 2019.10.30 14:47
-
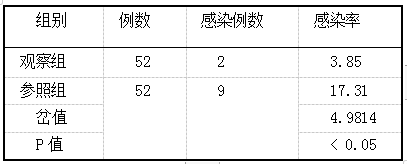
甲硝唑片官腔置入与左氧氟沙星口服对人工流产患者术后抗感染的临床疗效评价 2019.10.30 14:28
-
瑞舒伐他汀与常规降压药物联用对反勺型高血压患者降压疗效的影响 2019.10.30 11:35