血小板活化因子乙酰水解酶对局灶性脑缺血大鼠神经分泌素表达的影响
血小板活化因子乙酰水解酶对局灶性脑缺血大鼠神经分泌素表达的影响
王启征,张雄,曹裕民,徐玉玲,唐晓娜,王丽娟
摘要:目的 探讨重组人血小板活化因子乙酰水解酶( rPAF-AH)对局灶性脑缺血大鼠缺血区神经分泌素表达的影响。方法 选择SD大鼠45只,随机分为假手术组、生理盐水组、rPAF-AH组,每组15只,每组再分为2、7、14 d 3个时间点,每个时间点5只。生理盐水组和rPAF-AH组建立大脑中动脉栓塞模型。采用酶联免疫吸附法检测神经分泌素表达水平。结果 生理盐水组和rPAF-AH组2、7、14 d缺血区神经分泌素表达明显高于假手术组(P<0. 05),且rPAF-AH组2、7、14 d缺血区神经分泌素表达明显高于生理盐水组[(81. 76±9.14) ng/ml vs (40. 89±4. 32) ng/ml, (114. 49±5.79) ng/ml vs( 50. 39±5.22) ng/ml, (88. 82±9.79) ng/ml vs (40. 17±3.00) ng/mI,P<0. 01]。结论rPAF-AH能够上调局灶性脑缺血大鼠神经分泌素表达,可能对脑缺血神经重构起促进作用。
关键词:血小板活化因子;脑缺血;氧化性应激;分泌粒蛋白质Ⅱ
Effect of platelet activating factor acetylhydrolase on expression of neurosecretin in focal cerebral ischemia rats
Wang Qizheng,Zhang Xiong,Cao Yumin,Xu Yuling,Tang Xiaona,Wang Lijua
( Department o f Neurology ,Guangdong General Hospital ,Guangdong Institute of Neuroscience,Guangzhou 510080,Guangdong Province,China)
Abslract:Objective To study the effect of recombinant human platelet activating factor acetyl-hydrolase (rPAF-AH) on the expression of neurosecretin in focal cerebral ischemia rats. Methods Forty-five SD rats were randomly divided into sham operation group (n=15) ,normal saline group(n=15) and rPAF-AH group (n=15). The rats in each group were further divided int0 2-daygroup (n-5) ,7-day group (n=5) and 14-day group (n=5). A rat middle cerebral artery occlusionmodel was established. Expression of neurosecretin in different groups was detected by ELISA.Results The expression level of neurosecretin was significantly higher in normal saline group andrPAF-AH group than in sham operation group and in rPAF-AH group than in normal salinegroup on days 2,7 and 14 (81. 76+9. 14 ng/ml vs 40. 89+4. 32 ng/m1,114. 49+5. 79 ng/ml vs50. 39+5. 22 ng/m1,88. 82+9. 79 ng/ml vs 40. 17+3. 00 ng/ml,P can upregulate the expression of neurosecretin in focal cerebral ischemia rats,thus playing a role in promoting neural remodelling in focal cerebral ischemia rats.
Key words:platelet activating factor; brain ischemia; oxidative stress; secretogranin n
研究表明,脑缺血后不同阶段大脑功能和组织结构会出现多种可塑性变化,受损功能仍能得到不同程度的恢复。血小板活化因子(platelet activa-ting factor,PAF)是磷脂类生物活性介质及细胞因子。大量动物实验表明,PAF参与了脑梗死发生、发展的病理过程,与动脉粥样硬化、缺血性脑血管病的转归密切关联。重要的是,PAF可促进脑缺血后氧化应激,抑制神经细胞可塑性。PAF乙酰水解酶(platelet activating factor acetylhydrolase, PAF-AH)通过水解PAF使之失活,并与脂蛋白代谢和炎症途径相关口1。PAF-AH可上调胚胎干细胞分化为神经元,其亚单位可促进胚胎脑发育,并参与胚胎脑发育过程中的神经细胞迁移,对神经可塑性起促进作用。神经分泌素( SN)作为分泌粒蛋白Ⅱ前体保守的部分,可作为有效的趋化和血管生成细胞因子,具有诱导血管生成的治疗潜能口1。我们在前期研究的基础之上,进一步探讨人重组PAF-AH(rPAF-AH)对脑缺血后SN表达的影响。
1 材料与方法
1.1 材料和仪器 rPAF-AH购于Peprotech公司,大脑中动脉闭塞线栓购于北京西浓科技有限公司,大鼠分泌粒蛋白Ⅱ酶联免疫吸附试剂盒购于碧云天生物技术公司。
1.2 动物分组 SPF级健康雄性SD大鼠45只,体质量220~240'g,由中山大学动物实验中心提供,并于该中心屏障系统实验室饲养。随机分为假手术组、生理盐水组和rPAF-AH组,每组15只,每组再分为2、7、14 d 3个时间点,每个时间点5只。
1.3方法
1.3.1 脑缺血模型的制备 参照Longa等方法,腹腔麻醉后仰卧位固定,颈部正中切口逐层解剖,分离左侧颈总动脉,在距颈内动脉、颈外动脉分叉0.5cm处结扎颈总动脉,结扎颈外动脉起始部,血管钳夹住颈内动脉,颈总动脉近端剪一小口,将前端烧成圆头的直径0. 23 mm钓鱼线插入颈内动脉,插入线长17~22 mm时有阻挡感即停止,结扎颈总动脉根部固定栓线,逐层缝合。假手术组大鼠除未进行颈总动脉剪开、线栓置入及颈总动脉结扎缝合,余与生理盐水组和rPAF-AH组操作相同。给药方式利用大鼠脑立体定位仪进行,于前囟后0. 8~1.0 mm,头尾正中线左侧旁开1. 8~2.0 mm,深度4.O~5.omm,进行左侧侧脑室埋管。rPAF-AH组制模后即刻开始侧脑室注入rPAF-AH,剂量为50 vg/(kg.d)20,生理盐水组实验开始后侧脑室注入生理盐水20tjl/d,各组分别连续注射2、7、14 d。
1.3.2 脑组织取材保存经腹腔麻醉大鼠后,迅速断头取脑,置于冰上,取大脑中动脉缺血区视交叉后的冠状切块,在液氮内将脑组织研磨成粉末状,并将其装入1.5 ml的离心管中,加入RIPA裂解液,摇匀后放于冰上,充分震荡、混匀,在室温下裂解10min;在12 000 .r/min离心10 min后,取上清液分装于0.5 ml离心管中,并置于-80℃冰箱保存。
1.3.3酶联免疫吸附法检测SN表达 取冻存组织50 mg,加入0.5 ml预冷的PBS在冰上研磨成组织匀浆,12 000 r/min离心5 min,离心力13 217 g.吸取上清液,利用酶联免疫吸附试剂盒测定SN的吸光度,用CurveExpert软件绘制拟合曲线及方程,求出各样本SN表达。
1.4统计学方法采用SPSS 16.O统计软件,计量资料用x±s表示,两样本均数比较采用Student-t检验,多组计量资料采用单因素方差分析,P为差异有统计学意义。
2 结 果
生理盐水组和rPAF-AH组2、7、14 d缺血区SN表达明显高于假手术组(P<0.05),且rPAF-AH组2、7、14 d缺血区SN表达明显高于生理盐水组,差异有统计学意义(P<0.01,表1)。
表1 3组不同时间点SN表达比较(ng/ml,x±s,n=15)
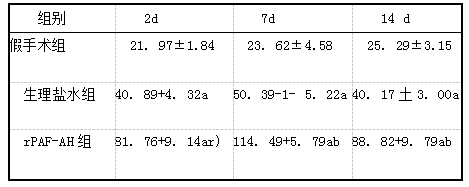
注:与假手术组比较,a P
3讨论
本实验结果显示,生理盐水组和rPAF-AH组2、7、14 d缺血区SN表达明显高于假手术组,并于7d时表达高,且rPAF-AH组2、7、14 d缺血区SN表达明显高于生理盐水组,表明SN表达在局灶性脑缺血急性期持续上升。因此,局灶性脑缺血后SN表达增加,rPAF-AH可能进一步上调SN表达。
我们前期研究通过Western blot证实,rPAF-AH分别能够在2、7、14 d上调局灶性脑缺血大鼠候选可塑性相关基因15蛋白表达,同时于7d时表达高。候选可塑性相关基因15表达可增强和诱导神经突延伸,树突生长和轴突再生,促进受损神经元细胞修复,同时可能与神经生长因子及血管内皮生长因子存在正性关系,对神经可塑性起促进作用。SN存在于神经内分泌细胞和神经元细胞的大致密核心囊泡中。SN在脑缺血模型、窒息性新生儿缺氧缺血模型中均表达升高口]。实验发现,SN以碱性成纤维细胞生长因子依赖性方式显示其对体外血管生成、增殖的积极作用,同时上调血小板衍生生长因子B表达,并对内皮细胞产生抗凋亡作用。血小板衍生生长因子B是调节细胞生长和分裂的众多生长因子之一。特别是,它能够促进新血管形成和生长。Albrecht-Schgoer等‘51进一步实验证实,硫酸乙酰肝素蛋白聚糖是SN诱导碱性成纤维细胞生长因子与内皮细胞结合的重要辅助因子。
先前的研究也发现,SN依赖硫酸乙酰肝素蛋白聚糖增加血管内皮细胞生长因子与人冠状动脉内皮细胞的结合,其推测SN的主要机制是刺激血管内皮细胞生长因子和碱性成纤维细胞生长因子对生长因子信号传导的低亲和力结合位点,提高了亲和力。SN在小鼠角膜新血管形成的测定中显示其作为血管生成因子的作用,同样也在小鼠后肢缺血模型中显示出对血管生成的诱导H]。SN能够激活内皮细胞中的一氧化氮合酶,一氧化氮合酶是一种重要的细胞信号分子,它有助于调节血管张力并参与血管形成。另一方面,SN通过减少损伤诱导的乳酸脱氢酶活性,阻断下游半胱氨酸天冬氨酸蛋白酶3活化和上调抗凋亡蛋白Bcl-2和Bcl-xl,起到神经保护作用。研究表明,体外SN诱导的毛细血管形成主要是诱导内皮细胞和内皮祖细胞增殖和定向迁移,并通过刺激促分裂原活化蛋白激酶和蛋白激酶B抑制这些细胞凋亡。在培养的大鼠主动脉平滑肌细胞中,SN诱导了定向的选择性迁移,刺激细胞增殖和DNA合成。
PAF是强诱导血小板聚集剂,并通过氧化应激抑制神经可塑性。rPAF-AH能够通过水解PAF,降低PAF活性,减轻PAF对神经重构的抑制作用。我们前期相关研究发现,rPAF-AH抑制脑缺血再灌注损伤所诱导的基质金属蛋白酶9高表达较PAF抑制剂银杏叶提取物更强,同时上调血管内皮生长因子基因和蛋白表达口]。在脑缺血早期基质金属蛋白酶9激活,增强炎性反应和硫酸软骨素蛋白多糖形成,抑制神经可塑性凹]。rPAF-AH可通过抑制基质金属蛋白酶9表达,减少脑水肿及白细胞浸润,促进神经重构。血管内皮生长因子则具有促进脑内神经元新生以及胶质细胞转化为新生神经元的作用,同时也增强在脑损伤修复中神经血管网络的重构凹1。因此,rPAF-AH可能通过抑制基质金属蛋白酶9和上调血管内皮生长因子表达而促进脑缺血神经可塑性。研究显示,在异丙肾上腺素处理后培养的心肌细胞中,也观察到SN的保护作用。SN显著增加过氧化氢酶和超氧化物歧化酶活性,使心肌细胞中活性氧水平降低,并观察到SN引起心肌细胞中磷酸化腺苷酸活化蛋白激酶(AMPK)、P38/丝裂素活化蛋白激酶(MAPK)和细胞外信号调节激酶( ERK)/MAPK通路的激活,但仅用AMPK抑制剂和ERKl/2/MAPK抑制剂的预处理抵消了SN抵抗心肌细胞肥大的保护作用和SN对心肌细胞氧化应激的抑制作用‘10]。这些结果表明,SN具有上调抗氧化剂i并抑制氧化应激,可能减轻PAF通过氧化应激,从而抑制神经可塑性。结合本实验研究结果,rPAF-AH能够上调局灶性缺血脑组织中SN表达,起到促进神经重构的积极作用。
综上所述,本研究结果发现,rPAF-AH可上调大脑中动脉栓塞模型大鼠局灶性脑缺血损伤诱导的SN表达,详细机制仍需进一步探讨。
参考文献
[1]王启征,王丽娟,张雄.脑缺血后神经可塑性的研究进展[Jl.中华老年心脑血管病杂志,2017,19(2):217-219. DOI:10.3969/j. issn. 1009-0126. 2017. 02. 030.
[2] Wechselberger K,Schmid A,Posod A,et al.Secretoneurin se- rum levels in healthy term neonates and neonates with hy-poxic-ischaemic encephalopathy[J].Neonatology, 2016, 110(1):14-20. DOI:10. 115 9/000444245.
[3] Posod A,Wechselberger K,Stanika RI,et al.Administration of secretoneurin is protective in hypoxic-ischemic neonatal brain injury predominantly in the hypoxic-only hemisphere
[Jl. Neuroscience, 2017, 352: 88-96. DOI: 10. 1016/j. neu-roscience. 2017. 03. 055.
[4] Albrecht-Schgoer K,Barthelmes J,Schgoer W,et al.Nanop-articular dehvery system for a secretoneurin derivative in-duces angiogenesis in a hind limb ischemia model[J].J Control Release, 2017, 250: 1-8. DOI: 10. 1016/j. jconrel. 2017.02. 004:
[5] Albrecht-Schgoer K,Schgoer W,Theurl M,et al.Topical se-cretoneurin gene therapy accelerates diabetic wound healingby interaction between heparan-sulfate proteoglycans and bas-ic FGF [Jl. Angiogenesis, 2014, 17(1):27-36. DOI: 10.1007/s10456-013-9375-4.
[6] Troger J,Theurl M,Kirchmair R,et al.Granin-derived pep-tides[Jl. Prog Neurobiol, 2017, 154: 37-61. DOI: 10. 1016/j. pneurobio. 2017. 04. 003.
[7] Wu Y,Wang L,Dai C,et al.Neuroprotection by platelet-acti-vating factor acetylhydrolase in a mouse model of transientcerebral ischemia[J]. Neurosci Lett,2014,558( 13): 26-30.DOI:10. 1016/j. neulet. 2013. 09. 005.
[8] Kurzepa J,Kurzepa J,Golab P,et al.The significance of ma-trix metalloproteinase (MMP)-2 and MMt)-9 in the ischemicstroke[Jl. Int J Neurosci, 2014, 124( 10): 707-716. DOI:10. 3109/00207454. 2013. 872102.
[9] Magnusson JP,G? ritz C,Tatarishvili J,et al.A latent neuro-geme program in astrocytes regulated by Notch signaling inthe mouse[J]. Science,2014,346( 6206): 237-241. DOI: 10.1126/science. 346. 6206. 237.
[10] Chen HL,Liu Y,Jiang W,et al.Secretoneurin suppresse-s car-diac hypertrophy through suppression of oxidant stress[J].Eur J Pharmacol, 2018, 822(5):13-24. D()I: 10. 1016/j.ejphar. 2018. 01. 008.
-
论文打印要求是什么,单面还是双面? 132898
-
ieee论文什么水平,含金量如何? 71701
-
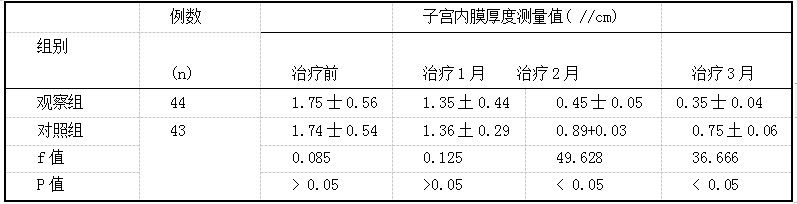
左炔诺孕酮不同给药途径对患者子宫内膜增生症的临床疗效评价 2019.10.30 15:05
-
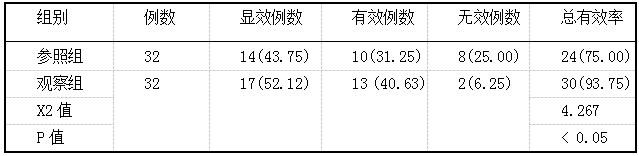
胸腺肽与恩替卡韦联用对患者原发性肝癌的临床疗效及其对预后的影响 2019.10.30 14:47
-
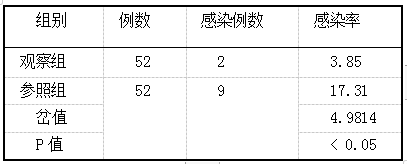
甲硝唑片官腔置入与左氧氟沙星口服对人工流产患者术后抗感染的临床疗效评价 2019.10.30 14:28
-
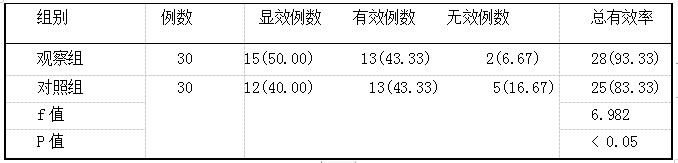
瑞舒伐他汀与常规降压药物联用对反勺型高血压患者降压疗效的影响 2019.10.30 11:35