依折麦布和瑞舒伐他汀通过肝X受体仪一三磷酸腺苷结合盒转运体Al对胆固醇的影响
依折麦布和瑞舒伐他汀通过肝X受体仪一三磷酸腺苷结合盒转运体Al对胆固醇的影响
李佳,员旭红,马倩倩,刘雅婧,申晓或
摘要:目的 研究瑞舒伐他汀、依折麦布及两者联合是否通过肝X受体a(I_XRa)-_磷酸腺苷结合盒转运体Al(ABCAl)信号通路影响血管平滑肌细胞(VSMC)来源的泡沫细胞胆固醇水平。方法 取大鼠胸主动脉3~5代VSMC进行实验,分为9组:对照组,不干预,仅单独培养VSMC48 h;模型组,用氧化型LDL(ox-I>DL 50 tig/ml)诱导VSMC,单独培养48 h;依折麦布A组(3.O ymol/L)、依折麦布B组(10.O Umol/L)、依折麦布C组(30.O ymol/L)、瑞舒伐他汀A组(0.1 Umol/I_)、瑞舒伐他汀B组(1.Ofimol/L)及瑞舒伐他汀C组(5.Orimol/L)在用ox-LDL 50tig/ml诱导VSMC基础上,分别加入不同剂量的依折麦布或瑞舒伐他汀培养24 h;联合组,在用ox-LDL 50 tig/ml诱导VSMC基础上,加入依折麦布30.o pmol/L和瑞舒伐他汀5.OtLmol/I_,培养24 h。检测各组TC、游离胆固醇(FC)及胆固醇酯(CE)水平及各组细胞LXRa、ABCAl mRNA及蛋白表达水平。结果 与对照组比较,模型组TC、FC、CE水平显著升高,LXRa、ABCAl mRNA及蛋白表达明显降低(P<0.05);与模型组比较,瑞舒伐他汀C组、依折麦布C组及联合组TC、FC、CE水平显著减少,LXRa、ABCAl mRNA及蛋白表达显著增加(P<o.05);且联合组i,xra、abcal p="" mrna及蛋白表达水平明显高于依折麦布各组及瑞舒伐他汀各组(p<0.05)。结论瑞舒伐他汀、依折麦布及2个适浓度的联合均可以通过上调lxra、abca1表达,促进泡沫细胞中abca1介导的胆固醇的逆转运,减少胆固醇在细胞中蓄积,且联合组较单药组效果更显著。
关键词:胆固醇;动脉粥样硬化;小鼠,基因敲除;肌,平滑,血管;肌细胞,平滑肌;ATP结合匣式转运子
动脉粥样硬化(AS)中胆固醇的逆转运在维持胆固醇平衡及调控胆固醇代谢有重要的作用[1]。肝X受体(LXR)家族不仅是DNA结合的核受体超家族的成员,而且是配体依赖性核受体[2]。LXRa是LXR中的1个亚型,新研究表明,其在维持胆固醇平衡,抑制胰岛素抵抗、抗炎等方面都起到了重要的作用口[4]。据研究显示,荷脂细胞中约2/3的胆固醇依靠三磷酸腺苷结合盒转运体Al( ABCAl)和三磷酸腺苷结合盒转运体Gl( ABCGl)介导的主动运输,敲除ABCA1基因的小鼠,动脉管壁上斑块体积明显增大。已有研究发现,LXRa被激活后,血管平滑肌细胞( VSMC)中ABCA1和ABCG1的表达被上调,进而蓄积的胆固醇外流,SMC泡沫化过程被抑制,延缓AS进展。他汀类药物及依折麦布分别为临床上常用的调脂药物,通过加强胆固醇清除及抑制胆固醇的吸收,达到抗AS的作用[6-7]。本课题着重探讨瑞舒伐他汀、依折麦布及两者联合对氧化LDL(ox-LDL)诱导的血管平滑肌源性泡沫细胞胆固醇水平的影响及可能机制。
1材料与方法
1.1 材料与试剂 原代大鼠胸主动脉VSMC购自齐氏细胞有限公司;DMEM/F12培养液、油红O染液、总蛋白提取液、BCA蛋白定量试剂盒、凝胶配置试剂、胰蛋白酶、超敏增强化学发光检测盒(ECL)发光液购自武汉博士德生物公司;ox-LDL购自北京协生生物科技有限公司;RNA提取试剂盒、RNA逆转录试剂盒(Takala公司);PCR引物及荧光定PCR试剂盒(上海生工生物公司);依折麦布为默沙东制药公司馈赠,瑞舒伐他汀为京新药业公司。
1.2 细胞与分组
1.2.1 细胞培养 将大鼠胸主动脉VSMC置于15 %FBS及1%青链霉素的DMEM/F12培养液培养,3~5 d传1代,采用3~5代VSMC进行本实验研究。
1.2.2 泡沫细胞模型的建立 在3~5代VSMC中加入ox-LDL 50 yg/ml进行干预48 h后,采用油红O染色法鉴定,显微镜下观察细胞脂化的情况以确定模型的建立。
1.2.3 实验分组实验分为9组:对照组,不干预,仅单独培养VSMC 48 h;模型组,用ox-LDL 50tlg/ml诱导VSMC,单独培养48 h;依折麦布A组(3.Ollmol/L)、依折麦布B组(10.0pmol/L)、依折麦布C组(30.0ymol/L),瑞舒伐他汀A组(O.1llmol/L)、瑞舒伐他汀B组(1.0y_mol/L)及瑞舒伐他汀C组(5.0 tLmol/L)在用ox-LDL 50 tig/ml诱导VSMC基础上,分别加入不同剂量的依折麦布或瑞舒伐他汀培养24 h;联合组,在用ox-LDL 50 tig/ml诱导VSMC基础上,加入依折麦布30.O tLmol/L和瑞舒伐他汀5.O pmol/L,培养24 h。
1.3 RT-PCR检测LXRcc和ABCAl mRNA表达水平 采用Trizol试剂盒一步法提取总RNA,利用Nano Drop测定各组样品RNA的浓度及吸光度值。据逆转录试剂盒进行逆转录合成cDNA。采用SYBR Premix Ex TaqⅡ将逆转录产物进行PCR扩增。LXRa上游引物序列:5'-TTCTCAATCAT-GCCCAGTTG-3',下游引物序列:5'-AAGCGT-CAAGAAGAGGAGCA-3'。ABCA1上游引物序31U:5'-AATGGTCAATGGGAGGTTCA-3',下游引物序列:5'-TGGACAGGCTTTAG'GTCAGG-3'。RT-PCR反应结果获得CT值。两者mRNA表达相对量用7-AACT表示。
1.4 Western blot检测LXRa和ABCA1蛋白表达收集各组VSMC,加入蛋白裂解液(冰上裂解30mln),离心(13 000 rpm/min,4'C,15 min),采用BCA法测定蛋白浓度后,取80 tLg蛋白样本进行十二烷基硫酸钠一聚丙烯酰胺凝胶电泳(80 mV,60min后调整为120 mV,30 min)分离后,电转(160mA恒压,40 min),封闭、一抗孵育4℃孵育(兔来源LXRa 1:300比例稀释、小鼠来源ABCA1 1:3000比例稀释),二抗孵育室温孵育(山羊抗兔二抗、山羊抗鼠二抗均以1:5000比例稀释),电化学发光试剂显影。采用Image Lab软件分析蛋白条带体积和灰度值,计算各组蛋白的相对表达量。
1.5酶荧光化学法检测细胞内各种胆固醇水平收集各组细胞,加入500肛l正己烷/异丙醇(3:2)?昆合液,超声波作用(3 min),离心(800 r/min,15min),发射波长590 nm处测荧光值,测定游离胆固醇(FC)、总胆固醇(TC)、胆固醇酯(CE)水平。
1.6统计学方法采用SPSS 17.0统计软件分析,计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<o. p="" 05为差异具有统计学意义。
2 结 果
2.1 VSMC形态学观察 在低倍镜下观察,VSMC呈梭形或长梭形,成“峰一谷”样(图1);高倍镜下观察,VSMC细胞质内含有与其长轴平行纤维细丝,卵圆形的胞核居中(图2)。用o x-LDL干预48 h后,在油红0染色下可见胞内大量红色脂滴颗粒,确定脂化模型建立成功(图3)。
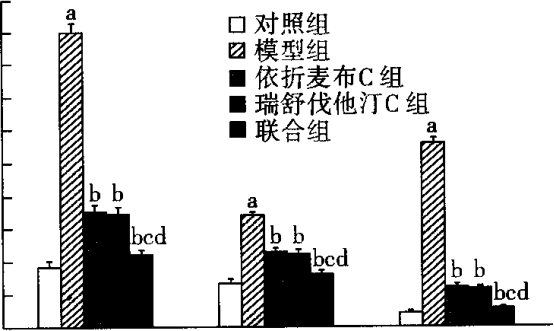
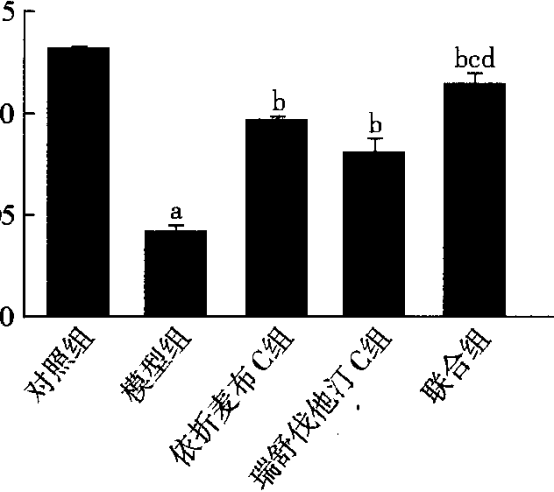
2.2各组VSMC内各种胆固醇水平比较 与对照组比较,模型组TC、FC及CE水平明显升高,差异有统计学意义(P<o. p="" 05,图4)。依折麦布c组、瑞舒伐他汀c组及联合组tc、fc、ce水平明显低于模型组,差异有统计学意义(p<0.05)。与联合组比较,依折麦布c组和瑞舒伐他汀c组tc、fc、ce水平下降,差异有统计学意义(p<0.05)。
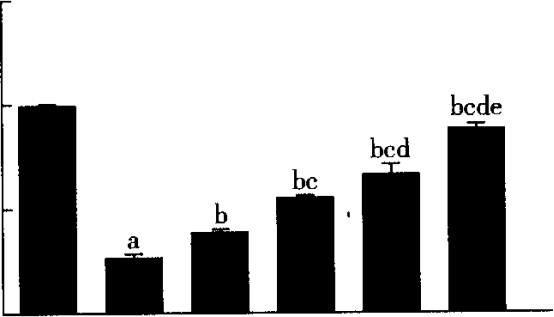
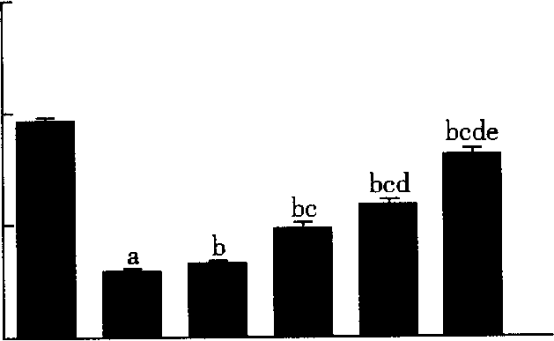
2.3 各组LXRa mRNA和ABCAl mRNA表达的比较 由图5~8可见,与对照组比较,模型组LXRa mRNA、ABCAlmRNA水平明显降低,差异有比较统计学意义(P<0.05)。依折麦布A、B、C组和瑞舒伐他汀A、B、C组及联合组LXRa mRNA、ABCAl mRNA表达水平明显高于模型组,差异有统计学意义(P<0.05)。依折麦布A、B、C组及瑞舒伐他汀A、B、C组LXRa mRNA、ABCAlmRNA水平均逐渐升高,呈一定浓度依赖性(P<0.05)。联合组LXRa mRNA、ABCAlmRNA水平明显高于依折麦布各组及瑞舒伐他汀各组,差异有统计学意义(P<0.05)。
注:与对照组比较,aP<o.05;与模型组比较,6p<o. p="" 05<="" 05;与依折麦布c组比较,ep<o.="" 05;与依折麦布b组比较,dp<o.="" 05;与依折麦布a组比较,cp
图5依折麦布各组与对照组及模型组LXRa mRNA表达的比较
注:与对照组比较,aP<o. p="" 05<="" 05;与依折麦布c组比较,ep<o.="" 05i与依折麦布a组比较,cp<0.05,与依折麦布b组比较,dp<o.="" 05;与模型组比较,bp
图6依折麦布各组ABCAl mRNA表达的比较
注:对照组比较,aP<o. p="" 05<="" 05;与模型组比较,bp<o.="" p<o.="" 05,与瑞舒伐他汀c组比较,8="" 05;与瑞舒伐他汀b组比较,dp
图7 瑞舒伐他汀各组LXRa mRNA表达的比较
注:对照组比较,aP<o. p="" 05<="" p<o.="" 05;与瑞舒伐他汀a组比较,c="" 05;与瑞舒伐他汀c组比较,8="" p<o.05;与瑞舒伐他汀b组比较,dp<o.="" 05;与模型组比较,6p
图8 瑞舒伐他汀各组ABCAl mRNA表达
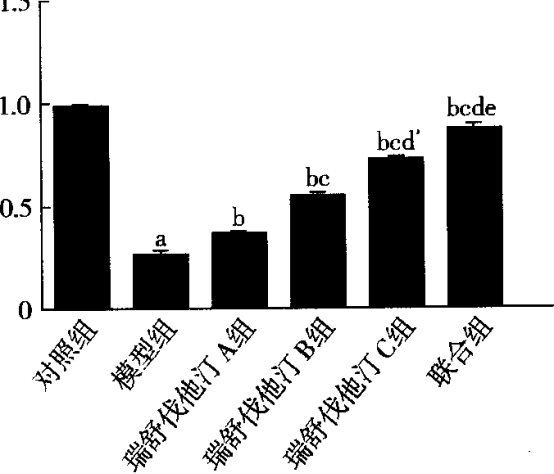
2.4 各组LXRa及ABCA1蛋白表达的比较 与对照组比较,模型组LXRa、ABCA1蛋白水平明显降低,差异有统计学意义(P<0.05)。依折麦布C组、瑞舒伐他汀C组及联合组LXRa、ABCA1蛋白表达水平明显高于模型组,差异有统计学意义(P<0. 05)。联合组LXRa、ABCA1蛋白表达水平明显高于依折麦布C组及瑞舒伐他汀C组,差异有统计学意义(P<o. p="" 05,图9~10)。
注:与对照组比较,a P<o. p="" 05<="" 05;与模型组比较,bp<o.="" p<o.="" 05;与瑞舒伐他汀c组比较,ap
图10各组ABCA1蛋白表达的比较
3讨论
胆固醇的外流主要有三种方式:膜孔扩散、B族工型清道夫受体介导的易化扩散、ABCA1和ABCG1介导的主动运输[8]。LXRa是核受体家族成员之一,在脂质代谢中起重要作用,其靶基因,如ABCA1、ABCG1、ABCG5、ABCG8均参与胆固醇的逆转运过程[9]。据研究显示,ABCA1和ABCG1表达的上调可促进细胞胆固醇的外流,减少胆固醇的蓄积[10]。有实验证明,LXRa可上调ABCA1的表达通过ABCAl-载脂蛋白A-工通路抑制血管壁的脂质堆积[11]。近年来有研究表明,在AS动物模型晚期病变中,平滑肌细胞为泡沫细胞的主要来源,占45% [12]。因此,研究减少VSMC来源的泡沫细胞的形成,可有效减少细胞内胆固醇的蓄积。
研究证实,他汀类药物可促进LXRa活化,作用于其靶基因ABCAl/ABCG1,从而促进细胞内胆固醇的流出[13]。多项实验表明,过氧化物酶体增殖剂激活受体a、7可被他汀类药物调控,进而作用于LXRa,促进下游ABCA1表达,实现胆固醇的逆转运,延缓AS过程[14]。在本研究中,用不同剂量的瑞舒伐他汀干预o x-LDL模型后,瑞舒伐他汀各组VSMC内TC、FC、CE水平明显低于模型组,LXRa、ABCA1表达明显增加,且表达呈一定的剂量依赖性。说明瑞舒伐他汀可能通过上调LXRa和ABCA1的表达,促进胆固醇的流出,进而延缓AS的进展。依折麦布可通过ABCA1、ABCG1、小凹蛋白1(Caveolin-l)这些脂质蓄积调控子,发挥抗AS效应。此外,也可激活平滑肌细胞的胆固醇调节元件结合蛋白1,上调ABCA1和Caveolin-l的表达,降低胆固醇的水平。本实验中,依折麦布各组TC、FC、CE水平明显低于模型组,LXRa、ABCA1表达量明显增加,且其基因及蛋白表达呈一定的剂量依赖性。
他汀类药物调脂特点是起始剂量就有良好调脂疗效。当剂量增倍时,LDL-C降低幅度仅约6%。且很多患者服用中等强度他汀类药物后,其LDL仍不能降到目标值以下。综合考虑到患者的获益和安全性,因此联合依折麦布调脂治疗。本研究中用适浓度的瑞舒伐他汀和依折麦布对联合组进行干预,较瑞舒伐他汀各组及依折麦布各组,LXRa、ABCAl mRNA和蛋白表达水平明显升高,胆固醇含量减少,提示两者可能共同通过LXRa-ABCAl途径来调节细胞内胆固醇的动态平衡,并减少脂质蓄积。
综上所述,依折麦布及瑞舒伐他汀均可减少胆固醇水平,上调LXRa、ABCAl mRNA及蛋白的表达,且两者以适浓度联合,其效果更显著,证明两者促进胆固醇外流,维持细胞胆固醇平衡可能通过共同的通路LXRa-ABCAl途径实现。此研究证实了将2种药物联合较单独用药更能明显的抑制胆固醇的外流。但是两者药物促进胆固醇外流是否还可以通过其他通路发挥作用,尚需进一步研究。
参考文献
[1]Ma Z,Deng C,Hu W,et al. Liver X receptors and their agonists:targeting for cholesterol homeostasis and cardiovascular diseases[Jl. Curr lssues Mol Bi01,2017 ,22 :41-64.
[2]Kazeminasab F, Marandi M, Ghaedi K, et al. Effects of a 4-week aerobic exercise on lipid profile and expression of LXRa in rat liver[Jl. Cell J,2017 ,19 (1) : 45-49.
[3]Fessler MB. The challenges and promise of targeting the liver X receptors for treatment of inflammatory disease[Jl. Pharmacol Ther, 2018 , 181 : 1-12.
[4]Guo Y,Yuan W,Yu B,et al. Synthetic high-density lipopro-tein-mediated targeted delivery of liver X receptors agonist promotes atherosclerosis regression[J]. EBioMedicine, 2018, 28 : 225-233.
[5] Liu XX, Zhang XW, Wang K, et al. Kuwanon G attenuates atherosclerosis by upregulation of LXRa-ABCAl/ABCGl and mhibition of NFKB activity in macrophages[J]. Toxicol Appl Pharmac01,2018, 341: 56-63.
[6] Peach M,Xu R,Fitzpatrick D,et aL Effect of evolocumab on cholesterol synthesis and absorption[J]. J Lipid Res, 2016 , 5 7(12 ) : 2217-2224.
[7]Chan DC,Watts GF. PANACEA or much a do about nothing:effect of a statin and ezetimibe on postprandial lipaemia and endothelial function in the metabolic syndrome[J]. Athero-sclerosis,2013 ,227 (1) : 32-34.
[8]Berrougui H,Khalil A. Age-associated decrease of high-density lipoprotein-mediated reverse cholesterol transport activity [Jl. Rejuvenation Res, 2009, 12 ( 2 ) : 117-126.
[9]Liang B,Wang X, Bian Y, et al. Angiotensin-( 1-7) upregulates expression of adenosine triphosphate-binding cassette trans-porter Al and adenosine triphosphate-binding cassette trans-porter Gl through the Mas receptor through the liver X receptor alpha signalling pathway in THP-1 macrophages treated with angiotensin-[[ [Jl. Clin Exp Pharmacol Physiol, 2014 , 41(12 ) :10 2 3-10 3 0.
[10]Jiang T,Ren K,Chen Q,et al. Leonurine prevents atherosclerosis via promoting the expression of ABCAl and ABCGl in a PPAR-t/LXRa signaling pathway-dependent manner[J]. Cell Physiol Biochem, 2017 , 43 ( 4) : 1703-1717.
[11]Xu B,Gillard BK,Gotto AM Jr,et'al. ABCAl-derived nascent high-density lipoprotein-apolipoprotein AI and lipids metabolically segregate[J]. Arterioscler Thromb Vase Biol, 2017 , 37 (12) : 2260-2270.
[12] Lao KH, Zeng L, Xu Q. Endothelial and smooth muscle cell transformation in atherosclerosis [Jl. Curr Opin Lipidol, 2015 , 26 ( 5 ) : 449-456.
[13]Barroso E, Rodriguez-Calvo R, Serrano-Marco L, et al. The PPARp/a activator GW501516 prevents the down-regulation of AMPK caused by a high-fat diet in liver and amplifies the PGC-la-Lipin l-PPARa pathway leading to increased fatty acid oxidation[J]. Endocrinology,2011 ,152 ( 5) :1848-1859.
[14]Shavva VS,Bogomolova AM,Nikitin AA,et al. FOX01 and LXRa downregulate the apolipoprotein A-I gene expression during hydrogen peroxide-induced oxidative stress in HepG2 cells[J ]. Cell Stress Chaperones, 2017, 22 ( 1 ) : 123-134.
[15]Ontsouka CE, Burgener IA, Mani 0, et al. Polyunsaturated fatty acid-enriched diets used for the treatment of canine chronic enteropathies decrease the abundance of selected genes of cholesterol homeostasis[Jl. Domest Anim Endocrin01,2010 ,38 (1) : 32-37.
[16] Gong YZ,Sun SW,Yuan HY,et al. Ezetimibe-mediated protection of vascular smooth muscle cells from cholesterol accumulation through the regulation of lipid metabolism-related gene expression[J]. Pharmacology,2014 , 94 ( 5-6) : 214-222.
-
论文打印要求是什么,单面还是双面? 132322
-
ieee论文什么水平,含金量如何? 71494
-
医学硕士论文如何修改 2019.11.18 14:02
-
自血疗法联合氯雷他定治疗慢性荨麻疹的疗效观察 2019.11.18 11:26
-
Cynergy 1 064nmNd:YAG激光治疗中风险婴幼儿血管瘤疗效观察 2019.11.18 11:20
-
姜黄素及其衍生物抗菌抗炎作用研究进展 2019.11.18 10:50



