多西环素对慢性间歇缺氧所致的心房重构的改善作用
多西环素对慢性间歇缺氧所致的心房重构的改善作用
张凯,马作旺,刘瑞蒙,徐园园,张跃
基础研究
摘要:目的 探究多西环素对慢性间歇缺氧(CIH)所致大鼠心房重构的相关干预机制。方法 45只雄性SD大鼠 随机分为对照组、慢性间歇缺氧组(模型组)及多西环素干预组(干预组),每组各15只。模型组大鼠每日接受间歇 缺氧6h,持续30 d,干预组大鼠在间歇缺氧的基础上给予多西环素进行干预。行超声心动图检查之后,每组随机 挑选5只进行体外心脏电生理学实验,剩余10只大鼠留取心房组织进行病理学及分子生物学实。Masson染色 观察大鼠心房肌组织纤维化程度,实时荧光定量聚合酶联反应和Western blot用于检测心房组织中微小RNA ( miR)一1、miR-21、miR-29b、miR-30、miR-133a、miR-328、转化生长因子p1(TGF-(3i)及结缔组织生长因子(CTGF)表 达水平的变化。结果与对照组比较,模型组大鼠左心房胶原分数和心房颤动( AF)诱发率明显增加[(6.40土 0. 84)%vs (1. 50±0.23)%和(36.0±10.8)%vs (24.O±14.3)%,P<o. 05],af诱发率有所改善,但差异无计学意义(p="" 40±0.84)%,p0.05),miR-21、miR-133a、TGF-p./p肌动蛋白(p-actin)及CTGF/p-actin的表达水平明显改善。结论CIH可导致大鼠心房的结构重构和电重构,而miR-l、miR-21、miR-133a、miR-328、TGF-p,及CTGF表达水平的升高在心房重构中具有重要作用,多西环素可能通过干预miR-133a、TGF-p,、CTGF信号通路进而改善CIH导致的心房重构。
关键词:多西环素;缺氧;心房颤动;聚合酶链反应;微RNAs;转化生长因子p1
心房颤动(AF)是目前临床中常见的心律失常之一,是多种心脑血管疾病的危险因素[1]。虽然AF的病因尚未完全明确,但心房的重构是AF发生、维持的重要基质,尤其是以心房纤维化形式的结构重构是AF发生发展重要的病理生理机制,干预心房重构进程可能是未来干预AF的重要切入点[2]。微小核糖核酸( miRs)是一类长度为20~24个核苷酸的非编码单链RNA分子,近来发现miRs对基因的表达水平具有重要调节作用,在多种疾病的病理生理过程中发挥着重要作用。相关研究表明,miRs及致纤维化相关因子,如转化生长因子8.(TGF-[31)、结缔组织生长因子(CTGF)在AF患者的心房重构中扮演着重要角色[3-4]。多西环素是一种半合成四环素类抗生素,已应用于临床多年,有研究表明,多西环素在以纤维化为主要形式的细胞损伤修复中具有一定的改善作用[5-6]。而其干预靶点仍需要进一步探究,我们拟通过慢性间歇缺氧( CIH)建立大鼠心房重构模型口]。探讨多西环素对大鼠心房重构的干预作用及其干预机制。
1 材料与方法
1.1 实验动物及材料 45只雄性SD大鼠,12周龄,200~250 g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-000。自动调节式低压缺氧仪(新飞公司,南京),多西环素,小动物彩色多普勒超声仪( SONICS,USA),Masson染色试剂盒(建成公司,南京),Triazol试剂(Life technolo-gies,USA),反转录试齐0盒(TIANGEN Biotech,京),荧光染料(TransGen Biotech,北京),引物(华大基因公司,天津),RIPA裂解液(KeyGEN Bio-TECH,南京);蛋白酶抑制剂苯甲基磺酰氟(Key-GEN BioTECH,南京),抗大鼠B肌动蛋白 《3-actin)抗体( Proteintech,USA,1:4000),抗大鼠TGF-(3i抗体( (Abcam,USA,1:2000),抗大鼠CTGF抗体(Abcam,USA,1:2000)。
1.2分组及模型建立 45只雄性SD大鼠随机分为对照组、模型组、干预组,每组各15只,大鼠饲养遵循天津医科大学实验动物管理相关规定,每日将模型组与干预组大鼠置于低压氧舱内,循环充入氮气和氧气,使舱内氧浓度缓慢波动于8%~21%,每日接受间歇缺氧6h,共30 d[8]。干预组大鼠在缺氧的基础上经胃给予多西环素(30 mg/kg)。
1.3心脏彩色超声检查 模型建立结束后,称重,异氟烷麻醉大鼠并固定于动物平台上,行超声心动图检查,采集左心房内径( LAD)、左心室收缩末内径( LVESD)、左心室舒张末内径(LVEDD)、肺动脉血流加速时间(PAT),根据Haham提出的公式(79-0. 45×PAT)计算平均肺动脉压力(mPAP)。根据Teichholtz法[V一7.0/(2.4+D)×D3]计算LVEF。分别测量3个心动周期取平均值。
1.4病理学实验超声评估结束后,每组随机选取5只大鼠留取心房组织用于病理学研究,剪取心脏后分离心房组织,用预冷的磷酸盐缓冲液冲洗干净,浸泡于4%的中性甲醛中固定3d,之后进行组织脱水、石蜡包埋,低温存放。含心房组织的石蜡包块切片后60℃烘烤th,可用于各项病理学染色,Masson染色用于评估各组大鼠心房组织纤维化程度,胶原纤维呈现为蓝色改变,而心肌组织呈现为红色,通过计算心房组织胶原分数来进行各组间比较。胶原分数定义为蓝色面积/(蓝色面积十红色面积),每张玻片在400倍视野下随机拍摄5张图片行胶原分数分析。免疫组织化学染色用于观察心房组织TGF-(31、CTGF蛋白表达水平变化,阳性颗粒(棕褐色)数量及颜色深度与表达水平呈正相关。Image-pro plus6.O软件用于图像的分析和计算。
1.5 实时荧光定量聚合酶联反应( RT-qPCR)及Western blot实验 利用Trizol试剂、氯仿和异丙醇萃取大鼠心房组织内的总RNA,利用反转录试剂盒将总RNA逆转录为cDNA。miRs的检测先合成含颈环的cDNA,内参为U6,TGF-(3i与CTGF的内参为甘油醛-3 -磷酸脱氢酶(GAPDH)。7500 Re-al Time PCR系统用于目的基因的实时荧光定量检测,目的基因包括微小RNA( microRNA,miR)-l、miR-21、miR-29b、miR-30、miR-133a、miR-328、TGF-(3.及CTGF(表1),方法采用2-AAC。利用RIPA裂解液与蛋白酶抑制剂苯甲基磺酰氟裂解出组织中的总蛋白,加入十二烷基硫酸钠缓冲液后100℃煮沸10 min变性,之后加入到十二烷基硫酸钠聚丙烯酰胺凝胶板的凹槽中进行电泳,之后将凝胶中不同分子量的蛋白印迹到聚偏二氟乙烯膜上,5%浓度的脱脂牛奶封闭后一抗4℃过夜,TBST清洗3次,二抗孵育1~2 h,TBST清洗3次后曝光,目的蛋白包括TGF-(31和CTGF,Image lab soft-ware软件用于目的条带净光密度的采集,净光密度用于目的蛋白表达水平的比较,内参为(3-actin。
表1 引物序列
目的
序列(5 7到3)
熔解温度
(℃)
miR-l颈环
miR-l FP
miR-21颈环
miR-21 FP
miR-29b颈环
miR-29b FP
miR-30颈环
miR-30 FP
miR-133a
颈环
miR-133a FP
miR-328颈环
miR-328 FP
通用RP
U6
GAPDH
TGF-p
CTGF
GTCGTATCCAGTGCAGGGTCCGAG-
GTATTCGCACTGGATACGACATA- 74. 22
CAT
GCCGTGGAATGTAAAGAAGT 53. 35
GTCGTATCCAGTGCAGGGTCCGAG-
GTATTCGCACTGGATACGACATTT- 7 5. 04
GG
GCCGAGCTGGTAAAATGGAA 56. 00
GTCGTATCCAGTGCAGGGTCCGAG-
GTATTCGCACTGGATACGACCTA- 76. 45
AGCC
GCGGCGCTGGTTTCACATGGTG 63. 72
GTCGTATCCAGTGCAGGGTCCGAG-
GTATTCGCACTGGATACGACCTTC- 7 6. 4 5
CAG
GCGGCGTGTAAACATCCTCGACT 61. 99
GTCGTATCCAGTGCAGGGTCCGAG-
GTATTCGCACTGGATACGACATTT- 7 5. 04
GG
GCCGAGCTGGTAAAATGGAA 55. 40
GTCGTATCCAGTGCAGGGTCCGAG-
GTATTCGCACTGGATACGACACG- 76. 08
GA
TAATCTGGCCCTCTCTGCCC 59. 50
GTATCCAGTGCAGGGTCCGAGGT 63. 77
FP:CTCGCTTCGGCAGCACA 56. 00
RP:AACGCTTCACGAATTTGCGT 53. 35
FP: GGCACAGTCAAGGCTGAGAATG 5 9. 9 9
RP:ATGGTGGTGAAGACGCCAGTA 57. 80
FR:CGCTTCTGCTCCCACTCC 60. 00
RP:TGTTGCGGTCCACCATTA 54. 00
FP:CTTCCCGAGAAGGGTCAAGC 60. 39
RP:TTCCAGTCGGTAGGCAGCTA 60. 32
注:FP=正引物;RP-反引物
1.6体外心脏电生理迅速剪取大鼠心脏后,将主动脉连接至Langendorff灌流系统,建立体外心脏逆向灌流系统,在高位右心房、高位左心房及右心室分别连接1对电极,测量心房间传导时间(IACT)、高位右心房有效不应期( HRAERP)、高位左心房有效不应期( HLAERP)和AF诱发率,AF发作定义为给予3s的Burst刺激后持续时间>1 s。
1.7统计学方法采用SPSS 22.O软件进行统计分析,所有计数资料以x±s表示,多组间比较采用方差分析,P<o. p="" 05为差异有统计学意义。
2 结 果
2.1基础参数与彩色超声数据比较 与对照组比较,模型组大鼠心脏质量明显增加,模型组、干预组大鼠的mPAP显著升高,差异有统计学意义(P<0. 05)。LAD、LVEDD、PAT及体质量等比较,差异无统计学意义(P>O. 05,表2)。
表2 3组大鼠基础参数与彩色超声数据比较(x±s,n=15)
项目 | 对照组 | 模型组 | 干预组 |
体质量(g) | 408. 94:t36. 24 | 398. 5+38. 72 | 385土35. 47 |
心脏质量(g) | 1. 18士0.09 | 1. 38士0.17a | 1. 27±0.13 |
LAD( mm) | 3. 84±0.53 | 3. 84±0.43 | 3. 58土0.43 |
LVESD( mm) | 4. 41±0.55 | 4. 30±0.69 | 4. 22土0.48 |
LVEDD( mm) | 6. 93±0.47 | 6. 59±0.75 | 6. 66±0.67 |
PAT( ms) | 38. 50±2.16 | 27. 22土4.95 | 25. 68±5.76 |
LVEF(%) | 66. 91±7.01 | 64. 51±9.77 | 66. 81±8.23 |
mPAP(mm Hg) | 52. 68±0.97 | 57. 75土2. 23a | 58. 44+2. 59a |
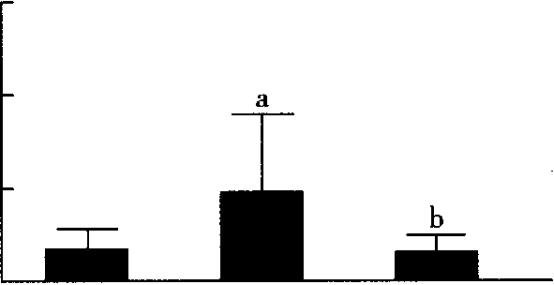
注:与对照组比较,aP<0.05;1 mm Hg=0.133 kPa2.2 3组大鼠左心房胶原分数比较 与对照组比较,模型组大鼠左心房胶原分数明显增加(P<0. 01);与模型组比较,干预组左心房胶原分数明显降低,差异有统计学意义(P<o. p="" 01,图1~4)。
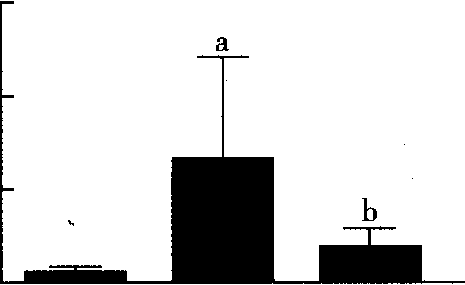
2.3 各组大鼠心肌纤维相关miRs表达水平比较与对照组比较,模型组大鼠心房组织miR-l、miR-21、miR-133a、miR-328的表达水平增加(P<0.01);与模型组比较,干预组miR-21、miR-133a的表达水平明显降低(P<o. p="" 05,图5~10)。
2.4 3组大鼠免疫组织化学染色比较模型组大鼠心房组织TGF-t31及CTGF的阳性颗粒明显高于对照组,而干预组有所改善(图11~16)。
对照组 模型组 干预组
注:与对照组比较,a P<o. p="" 01<="" ol;与模型组比较,bp
图1 3组大鼠左心房胶原分数比较



图2对照组 图3模型组 图4干预组图2~4 3组大鼠左心房组织Masson染色 ×400
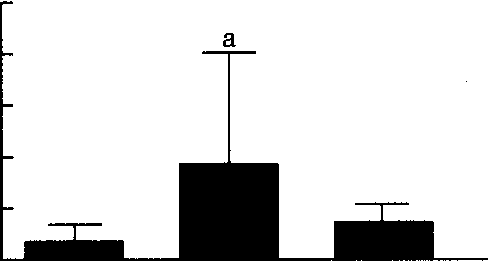
图5水平比较
图8水平比较TGF-BCTCF
对照组 模型组 干预组
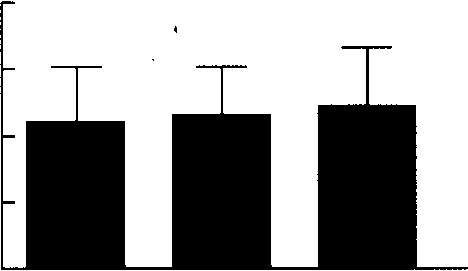
图9 3组大鼠心房组织miR-133a表达
注:与对照组比较,aP<o.01;与模型组比较,6p<o. p="" 05






图11对照组 图12模型组 图13干预组 图14对照组图15模型组图16干预组图11-16 3组大鼠心房组织免疫组织化学染色 ×400
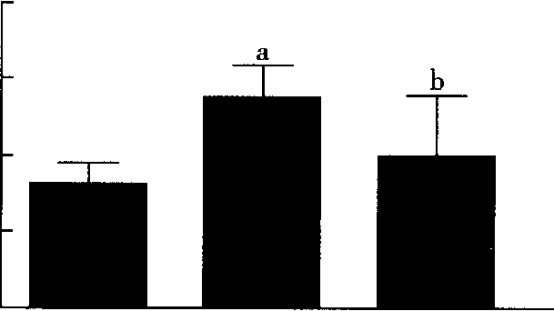
2.5 3组大鼠Iu房组织TGF-pi和CTGF表达水平比较模型组大鼠心房组织TGF-[31 mRNA以及CTGF mRNA与蛋白表达水平较对照组明显升高,干预组TGF-(31/(3-actin及CTGF/(3-actin的表达水平明显改善(图17~22)。
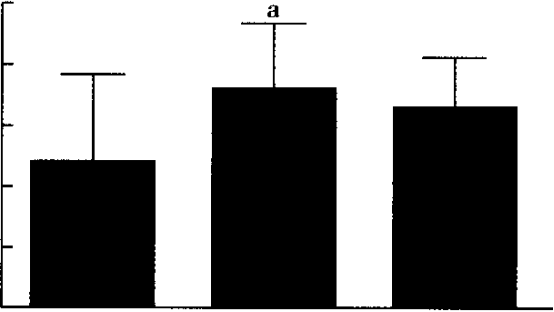
2.6 3组大鼠体外心脏电生理参数比较 与对照组比较,模型组大鼠AF诱发率显著增加(P<0.05),而干预组大鼠AF诱发率出现改善,但无显著差异(P>0.05,图23)。3组大鼠的心率、HRAERP、ICAT等比较,差异无统计学意义(P>O. 05,表3)。
对照组 模型组 干预组
注:与对照组比较,a P<o. p="" 05
图17 3组大鼠心房组织TGF-pl mRNA表达水平比较
对照组 模型组 干预组
注:与对照组比较,aP<o. p="" 05
图23 3组大鼠AF诱发率比较
表3 3组大鼠体外心脏电生理参数比较(i±s,n=5)
心率 (次/min) |
311.2土7.2 |
305.8±26.6 |
325.6±47.4 | |
IACT( ms) | 150 | 25.6±2.9 | 24.4±1.7 | 22.4±2.9 |
HRAERP ( ms) |
150 |
47.6土2.6 |
47.6±4.8 |
48.8土3.O |
HLAERP (ms) |
150 |
47.6士0.9 |
48.O±1.4 |
46.8±2.7 |
AF诱发率 (%) |
50 |
24.O±14.3 |
36.O±10.7 a |
33.0±8.2 |
3讨论
近来以来,miRs的作用逐渐得到重视,越来越多的研究结果表明,miRs在多种疾病的病理生理过程中发挥着重要的作用,miR-l、miR-21、miR-29b、miR-30、miR-133a、miR-328在心房组织中具有较高的表达水平,并且参与多种心脏疾病的进程中,尤其是在心肌纤维化、肥大中具有重要作用[9-10]。CTGF是促进多种纤维化疾病发生发展的重要因子,CTGF表达异常可以诱导成纤维细胞分泌胶原、趋化因子增加,进而导致细胞外基质的异常降解。此外,TGF-p,被认为是促进多种纤维化疾病发展的重要细胞因子[11]。CTGF作为TGF-(3.的下游效应因子,两者共同受到miR-133a的调控[12]。在纤维化疾病的代偿中,组织器官的实质细胞减少,取而代之的是无功能的胶原、结缔组织,是不良预后的重要原因。因而AF中有效干预心房重构可能是防控的切入点。本研究表明,CIH可通过多种机制促进大鼠心房重构,与对照组比较,模型组大鼠左心房胶原分数明显增加、AF诱发率明显增加,干预组给予多西环素干预后,左心房胶原分数明显降低、AF诱发率有所改善。基于此结果,我们探究了多西环素干预心房重构的相关分子机制,检测了多个心肌纤维化相关miRs的表达水平,RT-qPCR的结果表明,与对照组比较,模型组大鼠心房组织miR-l、miR-21、miR-133a、miR-328的表达水平明显增加,与模型组比较,干预组miR-21、miR-133a的表达水平明显降低。尤其是miR-133a的表达水平改变更为明显。之后我们检测了miR-133a下游效应因子TGF-(3,、CTGF的表达水平,结果表明,与对照组相比,模型组大鼠心房组织TGF-(3i、CTGF的表达水平明显升高,而干预组TGF-{31、CTF的表达水平与模型组相比均出现了改善趋势。
这些研究结果表明,CIH导致的大鼠心房重构与miR-l、miR-21、miR-133a、miR-328、TGF-(3i、CTGF表达水平升高密切相关,而多西环素可能是通过调节miR-21、miR-133a、TGF-(3i、CTGF的表达水平改善大鼠的心房重构。以往的部分研究探讨了心房重构动物模型中miR-133a的表达水平的改变,miR-133a及下游效应因子TGF-(3i、CTGF在心房重构中具有重要的调节作用,但是,miR-133a的水平变化仍然存在一定争议[13-14]。Kuwabara等[15]研究表明,心肌细胞损伤会促进miR-133a的表达水平升高,而循环中miR-133a的高表达水平提示心功能预后不良。这些研究结果提示,miR-133a在心肌纤维化、肥大等心血管疾病中具有调节作用,并且是重要的生物标志物。我们考虑,在CIH的过程中,miR-133a、TGF-(31、CTGF表达水平逐渐升高与心肌纤维化、心肌细胞损伤密切相关,而给予多西环素干预后,心房组织纤维化明显减轻,AF诱发率有一定改善,miR-133a、TGF-(3i及CTGF的表达水平明显改善,这提示多西环素可能通过调节miR-133a、TGF-(3i、CTGF信号通路有效减轻CIH导致的心房重构。
综上所述,miR-21、miR-133a、TGF-p-、CTGF的表达水平升高在CIH所致的大鼠心房电重构和以心房纤维化为主要改变的结构重构中具有重要作用,而多西环素可能是通过影响miR-133a、TGF-(31、CTGF信号通路对心房重构起到改善作用,期待更多的研究阐明miRs及其信号通路与心房重构的调控关系,探索AF综合治疗的干预靶点,为临床治疗提供新思路。
参考文献
[1]Schotten U,Verheule S,Kirchhof P,et al. Pathophysiological mechanisms of atrial fibrillation:a translational appraisaI[J].Physiol Rev,2011 ,91(1) : 265-325.
[2]Thanigaimani S, Lau DH, Agbaedeng T, et al. Molecular mechanisms of atrial fibrosis:implications for the clinic[Jl. Expert Rev Cardiovase Ther, 2017, 15 ( 4) : 247-256.
[3]Biernacka A,Dobaczewski M,Frangogiannis NG. TGF-p sig- naling in fibrosis[J]. Growth Factors,2011 ,29(5):196-202.
[4]Ko WC, Hong CY,Hou SM,et al. Elevated expression of connective tissue growth factor in human atrial fibrillation and angiotensinⅡ-treated cardiomyocytes[J]. Cire J,2011, 75(7):15 92-1600.
[5]Hua XF, Li XH, Li MM, et al. Doxycycline attenuates paraquat-induced pulmonary fibrosis by downregulating the TGF-p signaling pathway [Jl.J Thorac Dis, 2017,9(11): 4376-4386.
[6]Wang W,Zhang K,Li X,et aL Doxycycline attenuates chronic intermittent hypoxia-induced atrial fibrosis in rats[J]. Cardio vase Ther, 2018, 36(3):e123 21.
[7]李雄风,王卫定,张凯,等.慢性间歇缺氧对大鼠心房结构重构的影响[Jl.中华心律失常学杂志,2017,23(5):421-425.
[8]张凯,王卫定,赵志强,等.慢性间歇缺氧心房重构模型的建立[J].天津医科大学学报,2017,23(6):498-501.
[9]Yu H,Lu Y, LiZ,et al. microRNA-133: expression, function and therapeutic potential in muscle diseases and cancer[J]. Curr Drug Targets, 2014, 15(9):817-828.
[10]Sui Y, Zhang X, Yang H, et aL MicroRNA-133a acts as a tumour suppressor in breast cancer through targeting LASP1[J]. Oncol Rep, 2018, 39( 2): 473-482.
[11]Luong VH,Chino T,Oyama N,et al. Blockade of TGF-beta/smad signaling by the small compound HPH-15 ameliorates experimental skin fibrosis[J].Arthritis Res Ther, 2018, 20(1):46.
[12]Tsai CC,Wu SB,Kau HC,et al. Essential role of connective tissue growth factor( CTGF) in transforming growth factorp1( TGF-pi )-induced myofibroblast transdifferentiation from Graves' orbital fibroblasts[Jl. Sci Rep, 2018,8(1):7276.
[13]Liu Y,Liang Y,Zhang JF,et al. MicroRNA-133 mediates cardiac diseases: mechanisms and clinical implications [Jl. Exp Cell Res, 2017, 354(2):65-70.
[14]Angelini A,Li Z,Mericskay M,et al. Regulation of connective tissue growth factor and cardiac fibrosis by an SRF/micro RNA-133a axis[J]. PLoS One, 2015, 10( 10): e0139858.
[15]Kuwabara Y,Ono K, Horie T,et al. Increased microRNA-l and microRNA-133a levels in serum of patients with cardio vascular disease indicate myocardial damage[Jl. Cire Cardiovase Genet,2011,4(4):446-454.
-
论文打印要求是什么,单面还是双面? 132732
-
ieee论文什么水平,含金量如何? 71660
-
医学硕士论文如何修改 2019.11.18 14:02
-
自血疗法联合氯雷他定治疗慢性荨麻疹的疗效观察 2019.11.18 11:26
-
Cynergy 1 064nmNd:YAG激光治疗中风险婴幼儿血管瘤疗效观察 2019.11.18 11:20
-
姜黄素及其衍生物抗菌抗炎作用研究进展 2019.11.18 10:50



