巨噬细胞移动抑制因子对急性缺血性脑卒中患者神经功能缺损的预测价值
巨噬细胞移动抑制因子对急性缺血性脑卒中患者神经功能缺损的预测价值
李素萍,何保明,梁益,谢彦,许飞
摘要:目的 研究巨噬细胞移动抑制因子( MIF)在急性缺血性脑卒中(AIS)患者血浆中的表达及对其神经功能缺损的预测价值。方法 前瞻性连续性纳入我院神经内科首次新发AIS存活患者240例,依据神经功能恢复情况分为预后良好组136例和预后不良组104例。随访6个月,检测患者血浆MIF水平。结果 预后良好组年龄、心房颤动、LDI,-C、高敏C反应蛋白、颈动脉粥样硬化及MIF水平明显低于预后不良组[(61.4±9. 8)岁vs (63.3±11.4)岁,P=O. 017;13. 2% vs 24. 0%,P=0.031; (2. 69±0.64) mmol/L vs(2.97土1.01)mmol/L,P-0.009;(2. 12±0.71) mg/L vs (2. 59±0.67) mg/L,P一0.000; 16. 2% vs 46. 20/<,P—0.000;( 86. 76±16. 84) fig/L vs( 94. 23±15. 38) Vg/L,P—0.000],HI_D-C水平明显高于预后不良组[(1.21±0. 33) mmol/L vs (1. 09±0.29)mmol/L,P=O. 003]。不明原因型、其他原因型、大动脉粥样硬化型、心源型、小动脉闭塞型患者血浆MIF水平分别为(78. 42±17. 95)tig/L、(83. 75士10. 27)tig/L、(90. 73±14. 56) tig/L、( 97. 13±19. 96) tig/L、(103. 23士20. 15)llg/L,呈逐渐升高趋势(P<0.05)。MIF判断AIS患者不良预后的ROC曲线下面积为0.722(P<o. p="" mif可作为ais患者神经功能预后不良早期预测的有效生物标志物。
关键词:巨噬细胞;卒中;动脉粥样硬化;心肌梗死;生物学标记
随着我国人口老龄化进程,缺血性脑血管疾病已经成为危害我国中老年人健康的主要元凶[1]。急性缺血性脑卒中( AIS)为脑卒中常见类型其主要机制为动脉粥样硬化[2]。研究显示,炎性反应与动脉粥样硬化密切相关口]。炎性免疫反应在缺血性脑卒中事件中发挥重要作用,局部炎性反应加剧缺血半暗带的损伤,同时破坏血脑屏障,加重脑水肿[4-6]。巨噬细胞移动抑制因子( macrophage migration in-hibitory factor,MIF)由巨噬细胞分泌,参与多种自身免疫性疾病以及炎性疾病发生、发展的过程,并且与动脉粥样硬化形成密切相关。近期研究证实,MIF参与动脉粥样硬化的不稳定过程,可作为急性心肌梗死的有效生物标志物,与急性心肌梗死患者心肌梗死面积和不良预后事件独立相关。巨噬细胞在缺血性脑卒中的发生发展中也具有非常重要的作用,故本研究团队推测MIF可能也是AIS生物标志物,但目前MIF在AIS患者中的表达及其预测神经功能缺损关系尚未清楚,故本团队拟通过前瞻性研究探讨MIF在不同类型AIS患者中表达及其对神经功能缺损的预测价值。
1 资料与方法
1.1 研究对象 前瞻性连续选择2014年2月~2016年2月急诊收入我院神经内科住院的首次新发AIS患者246例,随访期间死亡6(2.4%)例,存活240例患者中,男性148例,女性92例,平均年龄(62.2±10.5)岁,TOAST分型:大动脉粥样硬化型41例、心源性脑栓塞22例、小动脉闭塞型75例,其他原因型64例和不明原因型38例。依据神经功能恢复情况将存活的240例患者分为预后良好组136例和预后不良组104例。AIS诊断标准参照《中国急性缺血性脑卒中诊治指南2014》[7]。排除标准:出血性脑梗死、短暂性脑缺血发作、肿瘤、伴严重肝肾功能障碍、免疫系统疾病、血液系统疾病、感染疾病和其他神经系统疾病。
1.2方法记录患者入院时年龄、性别、既往史、个人史及实验室检查,包括血脂( HDL-C、LDL-C、TC、TG)、空腹血糖、肌酐、高敏C反应蛋白(hs-CRP)等。生化检测采用仪器为贝克曼DxC800(贝克曼库尔特公司,美国)。患者神经功能情况采用美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评估;随访6个月后采用改良的Rankin量表(modified Rankin scale,mRS)评估脑卒中患者神经功能恢复情况,mRS<3分即为预后良好,mRS≥3分为预后不良。
1.3 血浆MIF水平的测定 患者禁食12 h后采集肘静脉血5 ml,3000 r/min离心20 min,取上清液,放置于-80℃冰箱待用。采用酶联免疫吸附试验测定患者血浆MIF水平,试剂盒由美国Avlscera Bioscience公司提供。
1.4 随访 患者出院后由神经内科医师进行门诊随访,随访时间分别为出院后1、3、6个月。随访事件主要为全因死亡和神经功能恢复情况。
1.5 统计学方法 采用SPSS 17.O和stata 13.0统计学软件。正态分布计量资料以x±s表示,不符合正态分布的计量资料以M( Qi,Q3)表示,2组组间比较采用独立样本£检验,多组间比较采用F检验(数据符合正态分布)或秩和检验(数据不符合正态分布),计数资料以频数、百分率表示,采用X2检验,采用ROC曲线评估MIF水平判断AIS患者不良预后的价值,采用多因素logistic回归分析AIS患者不良预后的独立影响因素,P<o. p="" 05为差异有统计学意义。
2 结 果
2.1 2组一般临床资料比较 2组男性、高血压、2型糖尿病、高脂血症、冠心病、吸烟、饮酒、TC、TG、空腹血糖、肌酐、发病到入院时间及NIHSS评分比较,无统计学差异(P>0.05)。预后良好组年龄、心房颤动、LDL-C、hs-CRP、颈动脉粥样硬化及MIF水平明显低于预后不良组,而预后良好组HLD-C水平明显高于预后不良组,差异具有统计学意义(P<o. p="" 05,表1)。
表1 2组一般临床资料比较
项目
| 预后良好组
(136例) | 预后不良组
(104例) |
P值
|
年龄(岁,x±』). | 61.4±9.8 | 63.3±11.4 | 0. 017 |
男性[例数(%)] | 80(58. 8) | 68(65. 3) | 0. 902 |
高血压[例数(%)] | 76(55.9) | 66(63.5) | 0. 237 |
2型糖尿病[例数(%)] | 50(36. 8) | 44(42.3) | 0. 383 |
颈动脉粥样硬化 [例数(%)] |
22(16. 2) |
48(46.2) |
0.000 |
心房颤动[例数(%)] | 18(13.2) | 25(24.O) | 0. 031 |
高脂血症[例数(%)] | 66(48. 5) | 62(59. 6) | 0. 088 |
冠心病[例数(%)] | 11(8.1) | 13 (12.5) | 0. 259 |
吸烟[例数(%)] | 72(52. 9) | 64( 61. 5) | 0. 183 |
饮酒[例数(%)] | 58(42. 6) | 50(48.1) | 0. 461 |
TC(mmol/L,x+s) | 4. 51±1.41 | 4. 89±1.68 | 0. 058 |
TG(mmol/L,x+s) | 1. 79士0.68 | 1. 71士0.72 | 0. 379 |
HLD-C(mmol/L,x+s) | 1. 21±0.33 | 1- 09土0.29 | 0.003 |
LDL-C(mmol/L,x+s) | 2. 69±0.64 | 2. 97±1.01 | 0.009 |
空腹血糖( mmol/L,x±5) | 6. 39±1.47 | 6. 27±1.78 | 0. 568 |
肌酐(timol/L,x士s) | 61. 96±11. 51 | 60. 76+12. 01 | 0. 433 |
hs-CRP(mg/L,x士s) | 2. 12±0.71 | 2. 59±0.67 | 0.000 |
发病到人院时间(h,x±5) | 6. 69±2.87 | 7. 01±2.63 | 0. 375 |
NIHSS评分(分,;±s) | 11. 96±5.11 | 12. 39±6.13 | 0. 554 |
MIF(yg/L,xi-s) | 86. 76土16. 84 | 94. 23+15. 38 | 0.000 |
2.2不同类型脑卒中患者MIF水平比较 不明原因型、其他原因型、大动脉粥样硬化型、心源型及小动脉闭塞型患者的血浆MIF水平分别为(78. 42±17. 95) tig/L、(83. 75±10. 27)rlg/L、(90. 73±14. 56) Ug/L、(97. 13±19. 96) tjg/L、(103. 23±20. 15) V_g/L,呈逐渐升高趋势,各组间比较具有统计学差异(P<0.05)。大动脉粥样硬化型患者MIF水平明显高于不明原因型患者;心源型患者MIF水平明显高于不明原因型和其他原因型患者水平;小动脉闭塞型患者MIF水平明显高于不明原因型、其他原因型和大动脉粥样硬化型患者水平,差异具有统计学意义(P<o. p="" 05,图1)。
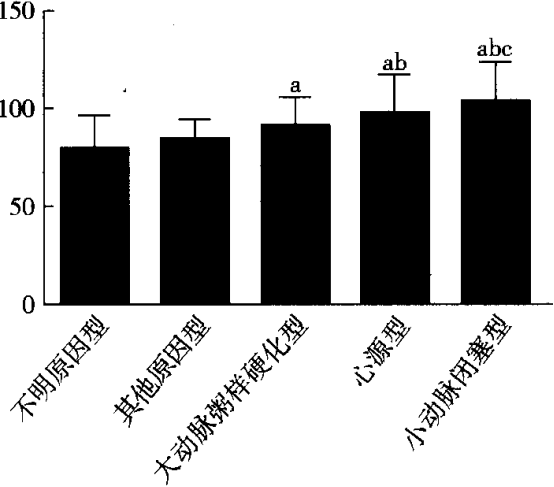
注:与不明原因型比较,aP<o.05;与其他原因型比较,bp<0. p="" 05<="" 05;与大动脉硬化型比较,cp
图1 不同类型脑卒中患者MIF水平比较
2.3 ROC曲线分析 ROC曲线分析显示,MIF水平判断AIS患者不良预后的ROC曲线下面积为0. 722(P<o. p="" 4%。
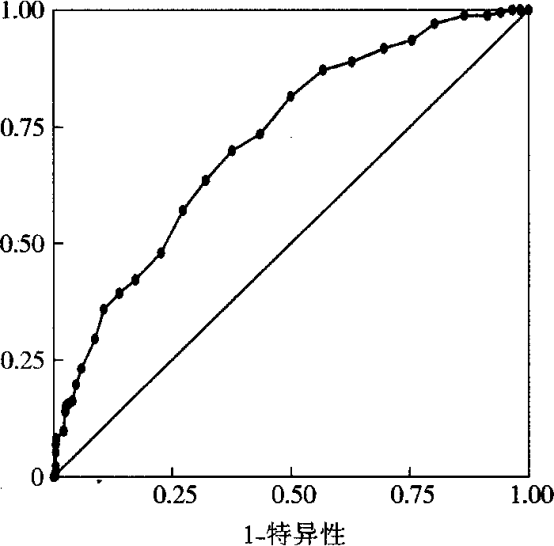
图2ROC曲线分析MIF判断AIS患者不良预后
2.4 AIS患者神经功能不良预后的影响因素 以6个月神经功能不良预后事件为因变量,以本研究收集的基本情况为自变量,logistic回归分析结果显示,MIF、年龄、心房颤动、肌酐和入院NIHSS评分是神经功能预后不良的独立危险因素(P<o. p="" 01,表2)。<="" 05,p
表2 AIS患者不良预后的多因素logistic回归分析
危险因素 | OR值 | 950/<CI | P值 |
MIF | 1. 008 | 1. 001~1. 021 | 0.000 |
年龄 | 1. 012 | 1. 003~1. 033 | 0. 032 |
心房颤动 | 1. 889 | 1. 327~2. 953 | 0. 014 |
肌酐 | 1.003 | 1. 000~1. 009 | 0. 022 |
入院NIHSS评分 | 1. 138 | 1. 049~1. 253 | 0.008 |
3讨论
缺血性脑卒中已经成为我国首位致死性疾病,每年我国新增约150万患者,其中约75%的患者遗留不同程度的肢体功能障碍,严重影响患者的生活质量,已经成为我国重大的公共卫生问题。
目前,动脉粥样硬化被认为是缺血性血管疾病的基础,多数学者认同脂质浸润学说、损伤反应学说、血栓形成与动脉粥样硬化有关,同时感染、炎性反应也是动脉粥样硬化的促发因素[8]。多种危险因素作用下,血管内皮细胞通透性增加,血液中脂质沉积于血管内膜,血液中单核细胞通过黏附分子作用粘附于损伤血管内皮形成巨噬细胞,经过其表面受体作用分泌血管活性物质加剧内皮细胞损伤、凋亡、坏死及脱落,同时激活的巨噬细胞表达细胞因子、生长因子促使血管平滑肌增生,形成纤维帽[9-10]。并且释放多种蛋白水解酶,加速纤维帽及其覆盖脂质斑块降解,使斑块稳定性降低[11]。MIF由激活巨噬细胞和T淋巴细胞产生受下丘脑一垂体控制并且对巨噬细胞移动起抑制作用的一种细胞因子,广泛存在于各种组织中,参与机体多种生理及病理反应[12-13]。研究发现,MIF水平和颈动脉不稳定斑块与进展性脑卒中的发生密切相关,血浆MIF水平越高斑块稳定性越差[14]。同时MIF可使转入核内的NF-IcB表达增加,促使炎性细胞基因表达,加重炎性反应。动物实验显示,随着动脉粥样硬化病程进展,MIF及其mRNA的表达均上调,运用单克隆抗体阻断MIF表达,可以延缓动脉粥样硬化病程进展,使斑块稳定性增加[15]。本研究中,不同类型脑卒中患者血浆MIF水平不同,小动脉闭塞型患者血浆MIF水平明显高于大动脉粥样硬化型。可能是由于小动脉血管闭塞导致局部脑组织缺血血氧,引发急性炎性反应,局部巨噬细胞浸润剧烈,血浆中产生更多MIF,因此高于大动脉粥样硬化型患者。
脂代谢紊乱导致脂质在血管内膜沉积,使机体持续处于微炎性状态,大量炎性因子释放入血[16]。近年研究发现,炎性反应贯穿动脉粥样硬化整个过程[17-18]。研究显示,氧化型LDL可显著提高细胞MIF水平,促进血管平滑肌迁移[19]。另有研究发现,冠心病患者血浆MIF水平明显高于非冠心病患者,TC、TG、LDL-C、脂蛋白a及载脂蛋白B水平MIF呈正相关,HDL-C、载脂蛋白B与MIF呈负相关,血浆MIF水平与Gensini积分呈正相关[20]。本研究预后良好组LDI_-C水平明显低于预后不良组,MIF是神经功能预后不良的独立危险因素。
综上所述,MIF在不同类型AIS患者血浆中均有不同程度的升高,是AIS患者神经功能不良预后的独立危险因素,可作为早期预测AIS患者神经功能的有效生物标志物。
参考文献
[1]Chistiakov DA, Melnichenko AA,Grechko AV, et al.Potential of anti-inflammatory agents for treatment of atherosclerosis[Jl. Exp Mol Pathol, 2018, 104(2):114-124. DOI: 10.1016/j. yexmp. 2018. 01. 008.
[2]Ogren J,Irewall AL,Bergstrom L, et al.Intracranial hemorthage after ischemic stroke:incidence,time trends,and predictors in a Swedish nationwide cohort of 196 765 patients[Jl.Cire Cardiovase Qual Outcomes, 2015,8(4):413-420.
[3]Ammirati E,Moroni F,Norata GD, et al. Markers of inflammation associated with plaque progression and instability in patients with carotid atherosclerosis[J]. Mediators Inflamm,2015, 2015: 718329.
[4]Dziedzic T. Systemic inflammation as a therapeutic target i acute ischemic stroke [Jl. Expert Rev Neurother, 2015, 15(5): 523-5 31. DOI:10. 158 6/14737175. 2015. 1035712.
[5]Zhou J ,Wu J ,Zhang J ,et al. Association of stroke clinical outcomes with coexistence of hyperglycemia and biomarkers of inflammation[J].J Stroke Cerebrovase Dis, 2015, 24(6):1250-1255.
[6]Nour M,Scalzo F,Liebeskind DS. Ischemia-reperfusion injury in stroke[Jl. Interv Neurol, 2013,1(3-4): 185-199.
[7]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015, 48(4):246-257.
[8]Raggi P,Genest J,Giles JT,et al. Role of inflammation in the pathogenesis of atherosclerosis and therapeutic interventions [J]. Atherosclerosis, 2018, 276: 98-108.
[9]Shapiro MD, Fazio S.From lipids to inflammation:new ap- proaches to reducing atherosclerotic risk[J]. Cire Res,2016,118(4):732-749.
[10] Nicholls SJ,Pisaniello AD,Kataoka Y,et al. Lipid pharmaco therapy for treatment of atherosclerosis [Jl. Expert Opin Pharmacother, 2014, 15(8):1119-1125.
[11]Zhang XL, Zheng SL, Dong FR, et al. Nimodipine improve.s regional cerebral blood flow and suppresses inflammatory factors in the hippocampus of rats with vascular dementia[J].J Int Med Res, 2012, 40(3):1036-1045.
[12]Tilstam PV,Qi D,Leng L,et aL MIF family cytokines in cardiovascular diseases and prospects for precision-based therapeutics[Jl. Expert Opin Ther Targets,2017 ,21(7):671-683.
[13]Martinez GJ,Celermajer DS,Patel S.The NLRP3 inflammasome and the emerging role of colchicine to inhibit atheroscle rosis-associated inflammation[Jl. Atherosclerosis, 2018, 269:262-271.
[14]刘运涌,楚兰.血浆巨噬细胞游走抑制因子和颈动脉斑块性质与进展性脑梗死的关系[J].中华老年心脑血管病杂志,2012,14(6):584-586.
[15]Makino A,Nakamura T,Hirano M,et al. High plasma levels of macrophage migration inhibitory factor are associated with adverse long-term outcome in patients with stable coronary artery disease and impaired glucose tolerance or type 2 diabetes mellitus[J].Atherosclerosis, 2010, 213(2):573-578.
[16]Thent ZC,Chakraborty C,Mahakkanukrauh P,et al. The molecular concept of atheromatous plaques[J]. Curr Drug Targets, 2017, 18( 11): 1250-1258.
[17]Soeki T,Sata M. Inflammatory biomarkers and atherosclerosis[J]. Int Heart J,2016, 57(2):134-139.
[18]ehta NU,Reddy ST. Role of hemoglobin/heme scavenger protein hemopexin in atherosclerosis and inflammatory diseases[J]. Curr Opin Lipidol, 2015, 26(5):384-387.
[19]杜雪霞,陈宝峰,邓芸,等.巨噬细胞移动抑制因子与2型糖尿病合并大血管病的关系研究[J].疑难病杂志,2015 (1):29-32.
[20]王芹,崔本亮,冠心病病人血浆MIF水平与冠状动脉病变的相关性[J].青岛大学医学院学报,2013,49(1):35-37.
-
论文打印要求是什么,单面还是双面? 132385
-
ieee论文什么水平,含金量如何? 71519
-
医学硕士论文如何修改 2019.11.18 14:02
-
自血疗法联合氯雷他定治疗慢性荨麻疹的疗效观察 2019.11.18 11:26
-
Cynergy 1 064nmNd:YAG激光治疗中风险婴幼儿血管瘤疗效观察 2019.11.18 11:20
-
姜黄素及其衍生物抗菌抗炎作用研究进展 2019.11.18 10:50



