干扰素调节因子4在Toll样受体3介导的小鼠流产过程中的作用及机制
干扰素调节因子4在Toll样受体3介导的小鼠流产过程中的作用及机制
武乃倩,田秀芳 天津市第五中心医院妇产科,天津300450
摘要:目的研究干扰素调节因子4(LRF'-4)在Toll样受体3(TI。R-3)介导的小鼠流产过程一}t的作用机制方法选取SPF级近交系Balb/C雌鼠、C57BL/6雄鼠,将孕鼠随机分为TLR -3抗体阻断组、CXC L.12抗体阻断组、lfJl清埘照组,_r-孕4.5、5.5、6.5 d连续腹腔注射TI.R-3抗体/CXCI。12抗体/血清,孕6.5、7.5 c1连续腹腔注射多聚次黄f1:酸胞11:酸…v(1:(:)或PBS。孕9.5、13.5、17.5 d时处死小鼠,计算胚胎吸收率,收集外周血、脾脏、子宫胎盘组织,利用小鼠淋巴细胞分离液分离外周m、脾脏、子宫胎盘来源的小鼠淋巴细胞,实时PCR法检测外周血、子宫胎盘来源的小鼠淋巴细胞f{I IRI:1-4 mRNA转录水平,流式细胞法检测外周m、脾脏来源的小鼠淋巴细胞中Th17细胞比例及子宫胎盘淋巴细胞中CXCR4阳。陀细胞比例,免疫组化法检测子宫胎盘组织中IRF-4蛋白表达水平。结果在外周血淋巴细胞中,Poly(I:C)诱导流产组的IRF-4 mRNA转录水平在孕9.5、13.5、17.5 d时显著高于对照组(P<0.05),且孕13.5 d时两组转录水平差异达到高;给产预先腹腔连续注射'rLR -3抗体后,Pc)l}i(I:C)诱导流产组的IRF-4 mRNA转录水平与对照组相比无明显差异(P=0. 867、0.931、0.953),在子宫胎盘来源的淋巴细胞中,IRF-4 mRNA转录水平的变化趋势与PBMCs类似,PolN(I:(:)诱导流广:组的IRF-4 rnliNA转求水平在孕9.5、13.5 d时显著高于对照组(P<0.01),在孕17.5 d时无显著差异(P=0. 504);给了预先腹腔连续注射T¨{一3抗体后,Poly(I:C)诱导流产组的IRF-4 mRNA转录水平与对照组相比无明显差异(P=0. 081、().219、0.178),,流式细胞法检测Th17细胞(CD4阳性、IL-17A阳性)比例。在PBMCs中,三个孕期时问点时,Poly(I:C)诱导流产组的(:I)4附阽、1…一17A阳性比例显著高于对照组(P IRF-4阴性细胞中,Poly(I:C)诱导组与对照组中CXCR4的表达无明差异(P=0.122),.免疫组化法检测r台胎蕊组织-ftIRF-4蛋白表达水平,P()ly(I:C)诱导流产组的IRF-4免疫组化光密度值在孕9.5、13.5 c1Ⅱ寸显著高于刈照组(,’<0.05),孕17.5【l时无明显差异(Jp=0.403);给予预先腹腔连续注射TLR -3抗体后,两组之问的表达差蚌尤统汁。’浮意义(P=0.664、0. 205、0.486)。,结论IRF-4在此流产过程中与对照组相比表达有差异,包括mRNA转录水平、蛋F1水平均有渺箐差异,TLR -3抗体预先阻断小鼠体内TT。R-3后,JRF-4转录及蛋白表达水平差异消失。
关键词:干扰素调节凶子4;信号转导;Fh17细胞;Toll样受体3
中国图书分类号:R392.1文献标识码:A文章编号:4001-4411( 2018) 10-2344-05;doi:lO.7620办gf/:j..i.issrl. 1001-4411. 2018. 10 58
干扰素调节因子4(IRF-4)是转录因子干扰素调节因子家族中的一员,参与各种免疫现象,包括免疫细胞调节、病原体的识别和造血干细胞的分化等。CXCR4是趋化因子受体12的特异性受体,对淋巴细胞具有强烈的趋化作用。淋巴细胞可从子宫外组织迁移入妊娠子宫内,调节细胞因子种类,从|fIj影响母胎界面的免疫耐受。,正常妊娠时母体免疫系统对胎儿及其附属物产生免疫耐受,而多种因素如感染、内分泌异常等都可使母体免疫系统排斥胎儿,引起流产。本实验研究r IRF-4在Toll样受体3(TLR-3)介导的小鼠流J抚过程中的作用机制,研究Th17细胞及其分化相关细胞闪子CXCR4在此流产过程中的作用,尝试探讨预防感染性流产的理论措施。
1材料与方法
1.1 材料动物模型所用动物:SPF级近交系Balb/C雌鼠、C57 BL/6雄鼠,10~12周,体质量(20±2)g(上海斯莱克实验动物中心及北京华阜康生物科技股份有限公司提供)。主要试剂:多聚次黄苷酸胞苷酸Poly(1:C)(美国Sigma Aldrich公司,货号P0913);TLR -3抗体(鼠抗CD283)(美国eBio-S【ilenie公司,规格:0.5 mg/ml,目录编号:14 -9032);CXCL 12抗体(美国R&D Systems公司,规格0.5mg/ml);TRIzol提取液(美国Invitrogen公司,规格:100 rnl);RNA逆转录试剂盒(日本TaKaRa Bictechnology公司);cDNA合成试剂盒(Fennentas公司);PE鼠抗CD4(美国eBioscience公司,规格:0.2 mg/ml,货号:12 - 0041);APC鼠抗/Rat IL - 17A(美国eBioscience公司,规格:0.2 mg/ml,货号:17 -7177);PE鼠抗CXCR4(美国R&D SVstems公司);IRF -4多克隆抗体(美国圣克鲁斯生物技术有限公司,规格:200 lxg/0.1 ml,货号:sc-11450);免疫组化试剂盒(北京中杉金桥生物技术有限公司,货号:PV -9000);DAB显色试剂盒(黄)(武汉博士德生物工程有限公司,货号:AR1022).
1.2 方法
1. 2.1 建立小鼠流产模型SPF级近交系Balb/C雌鼠与C57 BJ/6雄鼠饲养于本院动物实验中心。雌雄鼠1:l合笼,出现阴栓定为孕0.5 d。孕鼠随机分为4绀,每组小鼠数量为6~8只。Pc)ly(I:C)诱导流产组:孕6.5 cl、7.5 d给予孕鼠连续腹腔注射PolY(T:C)溶液,剂量为200 yg/20 g体质量,浓度为l mg/ml; PBS对照组:孕6.5(1、7.5 d给予孕鼠连续腹腔}卜射等体积的无菌PBS溶液;TT.R-3抗体阻断组:孕4.5、5.5、6.5 c{时给予孕鼠连续腹腔注射rl'LR_3 lf1和性抗体,剂量为5yg/200斗1;大鼠血清对照组:孕4.5、5.5、6.5 d时给予孕鼠连续腹腔注射等体积的大鼠Im.清。
1.2.2实时PCR.法检测不同部位来源的小鼠淋巴细胞中IRV-4 mRNA转录水平 严格按照相关试剂盒说明进行,得到每个标本不同指标的Ct值,根据公式2越Ⅲ1计算出所测指标的相对表达量。1.2.3流式细胞法检测小鼠外周血、脾脏来源的小鼠淋巴细胞中Th17细胞、CXCR4阳性细胞比例收集分离的淋巴细胞,用1ml冷PBS重悬,取io¨l细胞计数;将上述细胞分管,100 Lr,l/管,每管至少106个细胞;标记Blank、PE、APC、PE+A PC,根据标记分别加入不同染料的抗体;给予PE、PE+APC两管避光加入PE鼠抗CD4 1 LLl,充分混匀,在4℃或室温下避光染色30 min;将上管中加入l ml冷PBS、l 200 r/min离心、8~10 iiiin,然后弃上清,反复洗两次;4管中均加入2%多聚甲醛溶液500¨1,轻微振荡混匀,置于室温下20 min,充分同定表面抗体;破膜浓缩液与破膜稀释液1.:3配制破膜剂,每管加入300¨l,振荡混匀,室温下放置20 min,充分破膜;上述破膜的试管中加入1 ml冷PBS溶液,1 200 r/min离心,8~10 min,丢弃上清,反复洗两次;上述细胞沉淀加入100山冷PBS重悬,标记了APC、PE+APC的试管中避光加入APC鼠抗/Rat IL-17A 1¨l,充分混匀,4℃或室温下避光充分染色30 min;将上管中加入1 ml冷PBS、l 200 r/min离心、8~10 min,然后弃上清,反复洗两次;染色的试管中加入2%多聚甲醛溶液500山,室温下固定20 min上机检测,或4℃保存过夜。卜机圈出CD4阳性的淋巴细胞,后从CD4阳性淋巴细胞中圈出CD4阳性、IL-17A阳性细胞。采集图像,收集数据。
1.2.4免疫组化法检测小鼠子宫胎盘部位IRF-4蛋白表达严格按照相关试剂盒说明进行,显微镜下采集图像,染色强度用光密度值( OD)表示,Image -Pro Plus 6.0软件分析截取每个标本5个强染色区域的光密度值的平均值。
1.3 统计学分析所有数据均以FoxPr06.0软件建库,采用SPSS 16.0版软件包分析。流式细胞分析数据,免疫组化染色光密度值用(i±s)表示,组间比较采用£检验
2结果
2.1IRF-4 mRNA在小鼠外周血、子宫胎盘淋巴细胞中的表达水平Poly(1:C)诱导流产组外周血的IRF'-4 mRNA转录水平在孕9.5、1 3..5、17.5(1时显著高于对照组(P<0.05),且孕13.5 cl转录水平达到高;给予预先腹腔连续注射rrLR一3抗体后,Poly(I:C)诱导流产组外周血的1RF-4 mRNA转录水平与对照组相比无明显差异(P=0. 867、0.931、0. 953),子宫胎盘RF-4 mRNA转录水平的变化趋势与外周血淋巴细胞类似,Poly(J:C)诱导流产组的IRF-4 mRNA转录水平在孕9.5 d(外周血扛9.37,P 诱导流产组子宫胎盘的IRF-4 mR-NA转录水平与对照组相比无明显差异(P=0.081、0. 219、0.178)。
小鼠不同部位来源的淋巴细胞中IRF -4基因表达见表1、图1。
2.2 IRF-4蛋白在小鼠子宫胎盘组织中的表达水平免疫组化法检测子宫胎盘组织中IRF -4蛋白表达水平,Poly(I:C)诱导流产组的IRF-4免疫组化平均光密度值在孕9.5 d(f=9.76,P<0.05)、13.5 d(t=10. 85,P0. 05)。IRF-4蛋白在小鼠子宫胎盘组织中的表达水平见表2,小鼠胎盘组织DAB染色后的显微镜下观察见图2。
表1小鼠不同部位来源的淋巴细胞中IRF-4基因表达(x+s)
组别 | 外周血 | 子宫胎盘. | ||||
9.5 d | 13.5(1 | 17.5 d | 9.5 d | 13.5 d | 17.5(1 | |
PBS对照组 | 1. 98+0. 22 | 2 05+0. 23 | 1. 89 +0. 41 | 1. 27+0. 22 | 1. 35 t0. 23 | 1. 32+0.41 |
Poly(I:C)诱导流产组 | 11. 52+3. 21a | 25. 58+2. 54' | 5. 52+0. 69 | 7. 78+0. 54a | 6. 99 t0. 28“ | 2. 15 +0. 26 |
血清对照组 | 1. 87+0. 21 | 2. 08+0. 33 | 1. 96+0. 14 | 1. 24+0. 12 | 1 28 +0. 31 | 1. 26+0. 32 |
TLR-3抗体阻断组 | 1. 97 +0. 31 | 2 25 +0. 41 | 2. 28+0. 39 | 1. 58 +0. 41 | 1. 62+0. 21 | 1. 60+0. 16 |
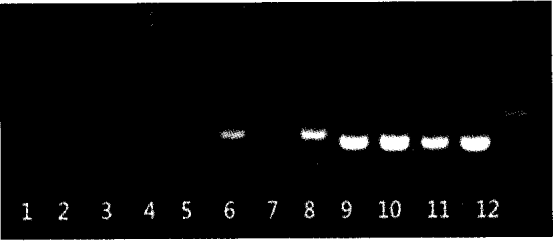
注:泳道1—4为小鼠外周血淋巴细胞中IRF-4基因表达,泳道5~8为小鼠子宫胎盘淋巴细胞中IRF-4基因表达,泳道9~12为p -actin.
图1小鼠不同部位来源的淋巴细胞中IRF-4基因表达
表2 IRF'-4蛋白在小鼠子宫胎盘组织中的表达水平(i±s)
组别 | 子宫胎盘 | ||
9.5(1 | 13. 5 d | 17.5 d | |
PBS对照组 | 0 20+0. 05 | 0 15 +0. 02 | 0 21+0. 07 |
Poly(I:C)诱导流产组 | 0. 38+0. 03 I | 0. 40+0. 0711 | 0. 29+0. 06 |
血清埘照组 | 0 21+0. 09 | 0. 18+0. 05 | 0. 17+0. 03 |
TLR-3抗体阻断组 | 0. 19+0. 02 | 0. 20+0. 02 | 0 24+0. 06 |
2.3 小鼠外周血与子宫胎盘淋巴细胞中Th17(CD4阳性、IL-17A阳性)细胞比例变化在小鼠外周血淋巴细胞中,孕9.5
d(£=2.83,P<0.05)、13.5 d(t=l. 88.P0.
05)。在小鼠子宫胎盘来源的淋巴细胞中,Th17(CD4阳性、IL-17A阳性)细胞比例变化趋势同外周血淋巴细胞。孕9.5 d(£=
6.91,P<0.05)、13.5 d(t=8.77, P<0.05)、17.5 d(t=5.46, P<0.
05)三个孕期时间点时,Poly(I:C)诱导流产组的CD4阳性、IL-17阳性比例显著高于PBS对照组。预先给予小鼠孕早期腹腔连续注射TI.R-3抗体阻断TLR
-3之后,Th17(CD4阳性、IL-17A阳性)细胞比例在抗体阻断组与血清对照组之间无明显差异(P>0.05)。见表3。
流产

图2小鼠胎盘组织DAB染色后的显微镜下观察(DAB染色,x400)
2.4 注射Poly(I:C)以及给予TLR-3阻断后小鼠子宫胎盘淋巴细胞中CXCR4表达模式的变化流式细胞染色分析发现,在IRF-4阳性细胞中CXCR4阳性表达率显著高于IRF -4阴性细胞(£=17. 02.P<0. 01);给予小鼠腹腔连续注射Poly(I:C)能使得小鼠子宫胎盘淋巴细胞中无论是IRF-4阳性还是阴性的细胞中CXCR4表达水平均上升(t=32.19,P<0. 01);预先给予小鼠孕早期腹腔连续注射CXCL12抗体阻断后,小鼠子宫胎盘淋巴细胞中无论是IRF-4阳性细胞还是IRF-4阴性细胞,CXCR4阳性表达率上升的现象消失。见表4。
表3小鼠外周血与子宫胎盘淋巴细胞中Th17(CD4阳性、IL-17A阳性)细胞比例变化(i±s,o)
组别 | 外周血 | 子宵胎盘 | ||||
9.5 d | 13.5 d | 17.5 d | 9.5(1 | 13.5'I | 17. 5(l | |
PBS XJ照红【 | 1. 1+0.1 | 1. 2+0.3 | 1.5 +0.4 | 0. 5+0.3 | 0. 8+0.3 | 0. 6+0.2 |
Poly(l:C)诱导流产组 | 1 3±0.2“ | 1. 6+0. 61 | 2.0+0. 7“ | 4.7±1 9 8 | 2. 4+0.5“ | 3.9±1.9“ |
向清对照组 | 1. 1+0.1 | 】.2+0.2 | 1.5 +0.2 | 1.7 +0.7 | 1. 6+0.5 | 】.3+0.5 |
TI。R-3抗体m断组 | 1.】+0.2 | 1. 2+0.3 | 1. 6+0.3 | 2. 4+0. 5 | 1.8 +0.3 | 1. 5+0.5 |
表4各组流式数据汇总分析(x+s,%)
组别 | IRF-4阴性 | lllF-4阳性 |
PBS对照组 | 2. 6+0.6 | 26. 8+2.2 |
I)()Jv(I:C)灞导流产组 | 10.8±1.4a | 59. 2+2. 3a |
血清对照组 | 0. 5+0. 2 | 0. 6+0.】 |
TI.R-3抗体阻断组 | 6. 5+0.8 | 28. 5+0. 7 |
3讨论
本实验建立r一个较为常用的小鼠流产模型,是由一种人工合成的病毒双链RNA类似物,即Poly(I:C),给予小鼠孕早期连续腹腔注射所诱导。Polv(I:C)能被机体的天然识别受体Toll样家族成员的TLR-3所识别,触发NF-KB途径活化以及引起促炎性细胞因子的分泌,终使得孕鼠体内的胚胎吸收和妊娠丢失1。。本研究发现,在此小鼠流产模型的不同时间点,Poly (I: C)诱导流产组小鼠孕早期和中期时(孕9.5 d、孕13.5 d)胚胎吸收率高于孕晚期(孕17.5 d),提示Poly(I:C)的致胚胎吸收作用可能是通过干扰小鼠胚胎早期的植入和妊娠中期时胚胎的发育而实现的。而在诱导流产注射之前,给予小鼠连续腹腔注射特异性TLR -3的中和性抗体之后,能完全消除Poly(I:C)的致小鼠胚胎吸收作用,说明Poly(I:C)的这种致胚胎吸收作用必须依赖Toll样受体通路的存在,而在此通路中,IRF-4被引起注意。
在早期研究中,IRF-4属于干扰素调节因子家族成员之一,在IRF-4缺失的小鼠身上,表现出进展性的淋巴结肿大和病变,比如患上多发性硬化[2]。IRF-4已知表达于浆细胞、生发中心B细胞以及活化T细胞中,对于免疫调节具有重要作用∞1。它能被多种促进有丝分裂的信号所诱导产生,比如抗原受体结合、细菌的脂多糖成分、CD40信号通路以及病毒的双链RNA结构等[4]在小鼠外周血淋巴细胞、子宫胎盘细胞中含有T细胞、B细胞以及单核细胞中[5]。IRF-4被认为与T淋巴细胞调节密切相关,并且在体外通过T淋巴细胞免疫参与清除病原体6。。在本研究中的小鼠诱导流产组中,IRF -4的mRNA和蛋白水平均显著高于对照组,然而当TLR-3被预先阻断后,这种升高的IRF-4效应被消除。这一现象说明IRF-4可能在TLR -3的信号通路中起重要作用并且与胚胎吸收的作用一致。在孕17.5 c1时,无论是诱导流产组还是对照组之间,小鼠子宫胎盘淋巴细胞的IRF-4无明显变化,这可能与妊娠后期小鼠母胎界面的淋巴细胞数量急剧下降有关。
近期有研究刊1显示,IRF -4缺失的小鼠表现为Th17细胞诱导、扩增和稳定缺失。在本研究中,Poly(I:C)诱导流产组的Th17细胞比例显著高于对照组,无论是在小鼠外周血淋巴细胞还是子宫胎盘来源的淋巴细胞中结果均一致,同样,预先给予TLR -3中和性抗体注射后,Th17细胞比例在诱导流产组并无增加,这些现象显示IRF-4可能是通过调节Th17
细胞的分化和扩增来引起小鼠胚胎吸收的。有研究报道,IRF-4缺乏的小鼠表现出产生IL-6、IL-17A等细胞因子的能力下降‘圳,其对11.- 17A、II.-21的产生来说是个关键性的转录因子。IL-6与TGF-B联合作用能提高孤核受体ROR^),t、信号转导、转录激活因子3信号的表达,进而调节Th17细胞分化。TGF-B由天然免疫细胞产生,与自身的特异性受体
相结合,诱导TGF -B受体I和Ⅱ结合,继而激活SMADs蛋白,活化的SMADs蛋白能与多个转录因子交互作用,从而引起染色体重构而使得TGF-B靶基因转录。IL-6和TGF-B共同存在时,能诱导IL-17的产生,而IL-21单独则能提高Th17的分化能力,通过自分泌的方式放大Th17细胞的功能和发展10。本研究也证实了在小鼠妊娠过程中,IRF-4在Toll样受体通路中发挥重要作用。
众所周知的外周免疫系统中控制CD8阳性T细胞分化的是T - box基因家族下的转录因子T- bet和Fomes基因,它们在效应性T细胞和记忆性T细胞的分化中起核心作用[11-12]。此外,转录因子Blimp -l2348被发现能驱动短效的效应T细胞的毒性作用,还能抑制转录因子Id2、Id3的活动,从而能拮抗E蛋白的DNA结合活性。抗原和与它同源的T细胞抗原受体之间的交互作用是T细胞反应结果的一个关键性因素,而T细胞反应的早期特点是不同的抗原特异性克隆具有广泛的亲和力,并伴随衍生肽表位抗原的增殖,后期则是由有限数量的无性系抗原为主,特别是那些具有较高亲和力的抗原[13-14]。这种定位重点在于T细胞反应克隆竞争的结果导致优势表位一特异性T细胞克隆的高亲和力,从而能对病原体进行关键性的控制定位[15-16]。
CD8阳性T细胞对高亲和力的抗原或低亲和力的抗原的募集、增殖和获取能力是类似的,然而,T细胞对低亲和力的抗原在感染过程中无法进行累积,从而只能在感染峰值时对抗原进行有效抵抗[17-19]。因此,T细胞的克隆扩增差异是多重作用的结果,包括细胞增殖和细胞死亡,尽管如此,T细胞抗原受体信号如何将不同的亲和力的配体进行相互作用的结果
翻译成不同的转录程序分化的结局仍不清楚。结合本研究中的发现,小鼠子宫胎盘来源的淋巴细胞中IRF-4的产生受Poly(I:C)的调节,由于CXCL 12能特异性地诱导CXCIA阳性细胞的产生,说明子宫外的CXCIA阳性细胞在受到CXCL12的刺激时,能够迁移人母胎界面的微环境中,因此在预先给予CX-CL12抗体阻断时,子宫外的CXCL4阳性细胞则不向母胎界面的微环境中迁移,这一发现也许能帮助解决预防Poly(I:C)或病毒诱导所引起的胚胎丢失。
综上所述,Poly (I: C)能诱导小鼠胚胎吸收率增高,同时伴随小鼠外周血淋巴细胞、子宫胎盘来源的淋巴细胞中干扰素调节因子4mRNA以及胎盘组织中IRF-4蛋白的表达升高;Poly(I:C)在诱导小鼠胚胎吸收的同时,能使小鼠外周血、脾脏淋巴细胞中Th17细胞的比例增高;Poly(I:C)能促进小鼠胎盘淋巴细胞中CXCR4表达,可能是通过CXCL12对CXCR4的募集作用,使其从子宫外向母胎界面迁移;预先阻断TLR-3之后,Poly(I:C)诱导小鼠胚胎吸收率的能力消失,IRF-4 mRNA以及胎盘组织中IRF-4蛋白的表达无明显改变,小鼠外周血、脾脏淋巴细胞中Th17细胞比例无明显变化,小鼠胎盘淋巴细胞中CXCR4表达也无明显改变。
参考文献
[1]Cay NJ, Cangjoff M. Scructure and function of' Toll receptors aml their Jigands[J] Annu Rev Biochcm, 2007, 76(1):141 -165.
[2]Ni A, Chen H, Wu Y,et al.F~xpresbiion(){IRV-4 ancl IBI' in skin lesions of patients with psoriasis vulgaris 'Jl. J Huazhong{ Univ S{:iTechnolog Med Sci, 2012, 32 (2): 287-290.
[3]张竹君,周玉,李鹏,等—个新的高保’、子rf身免疫反腹;f¨火分子IRF-4结合蛋白多克隆抗体制箭[Jl.第i0:医人’了:々:报,2008, 30 (13):1242-1245.
[4]Xu DS, Meyer F,Lhlers E,t-t al.Intctrlc:rc)n rftgulalory faciii)r 4 (IRF-4) targets IRF-5 L{)regulatv KflHtt-in-Harr viruh trajislorjna-tion[J] J Biol Chem, 2011, 286 (20): 18261-18267.
[5]Jo SH, Ren R.IRF-4 suppresses I3CI{/At31. transforrnacion¨f'mvc-loid cells in a DNA hinciirtg-in{lepentlenc manner[J].J l3i"l Chem.2012, 287 (3): 1770-1778.
[6]Jn SH, Schatz JH, Acquaviva J, (、t al.(:I Jt'f Jt-rali‘)Illwlwcen clcfi-ciencies of IRF-4 and IllF-8 prornotch h()th mycl"icl ar"l ly『I1I外l‘)id tu-morigenesis [J]. Blood, 2010, 116 (15): 2759-2767
[7]Brustle A, Heink S,Huher M,(-t aL The(I(-v{、】(’f)numt of'inllanirna-Lory TH-】7 cells requires intfirfcron -rcgulaiory fm-tor 4 [J]. Ntic Immunol, 2007,8(9): 958-966
[8]Chung Y, Chang SH, Martinez CJ,eI a J.Criiiral rfWilalion of early Th17 cell differentialion bv inlerlelJkin-l Hig:nkllin~: l J] IJnmunity,2009, 30 (4):576-587
[9]Weaver CT, Hatlon RD, Mang
[10]刘璐,刘爱平,杨瑜,等组织原化}L忆T细胞的研究进展[J].中华微生物学和免疫学杂志,2013, 35 (7): 552-555
[11]耿建,刘瑞霞,高西阳,等.C1113患行'11117 -Trff火衡tft I[J]的作用及机制[J].肝脏,2016, 21 (4): 259-262, 312
[12]洪海,吴K有.心忆性干细胞样T细胞的研究进脞[J].国际免疫学杂志,20J4, 37 (2): 117-121.
[13]刘健,章必成.CD8+调节件T细胞研究进展¨Jj l‰床误诊误治,2012, 25 (12):97-100.
[ 14]周超颖,马骊.T细胞交叉反应性研究进腱l J].iIi华微乍物学和免疫学杂志,2015, 35 (7):546-549
[15]余茜,徐蕾,何永林,等.细胞内病原体b'L。P J:琏川l的原核表达[J] 中国生物制品学杂。1,2012, 25(4): 426 -428, 436.
[16]士鹏鹏,柴艮斌,汪洋,等.CD8+T细胞激活和免疫记忆形成的分子调节机制[J].中华微生物学和免疫。#杂志,2015, 35(7):541-545.
[17]Yao S,Buzo I{F,Pham I),甜al l¨“,Imr(ⅢrI-gu JHmry h(.If'r 4 sus—Lains CD8(+)rIl(-eIl expansi()¨anIl t、m-(.“)I(1ⅢI】I1(-nI㈧hl[J].1mmunity, 2013, 39 (5): 833-845.
[18]靳昌忠,冯磊,谢火胜,等,高效抗逆转求病,辑治疗埘艾滋病患儿CD8+T细胞活化分子CD38和人类I’脚j胞抗原I)I{表达水平的影响及其与病毒载繁的关系[J].『f1华儿科杂志,2011,49 (1): 49-52.
[19]MacIver NJ, Michalek RD, Rathmell JC. Mrtal",lic- n~{ulation of"I' lymphocyles[J]. Annu Hev Immunc)l, 2013,3l (1):259 -283.
-
论文打印要求是什么,单面还是双面? 132695
-
ieee论文什么水平,含金量如何? 71648
-
医学硕士论文如何修改 2019.11.18 14:02
-
自血疗法联合氯雷他定治疗慢性荨麻疹的疗效观察 2019.11.18 11:26
-
Cynergy 1 064nmNd:YAG激光治疗中风险婴幼儿血管瘤疗效观察 2019.11.18 11:20
-
姜黄素及其衍生物抗菌抗炎作用研究进展 2019.11.18 10:50



