血管周围间隙扩大与颅内外动脉粥样硬化性狭窄的相关性
血管周围间隙扩大与颅内外动脉粥样硬化性狭窄的相关性
邢婷婷,严玉宁,魏文石
关键词:颅内动脉硬化;脑血管障碍;动脉粥样硬化;磁共振成像;脑血管造影术;C反应蛋白质
血管周围间隙是围绕在小血管周围的间隙结构,由穿支动脉和流出静脉进出脑实质时软脑膜内陷并伴随在血管周围延续而成。其内界为血管外层,外界为星形胶质细胞足突等组成的胶质界膜,胶质界膜随穿支血管延伸至毛细血管水平并与血管外层融合成为盲端。血管周围间隙可见于任何人,是脑组织排出组织间液的重要结构,正常时为镜下结构,当其直径增大至0. 66mm时,普通MRI即可发现,此时称为血管周围间隙扩大(enlarged perivas-cular spaces,EPVS)2]。
既往研究发现,不同部位EPVS的危险因素不同,预示着不同部位EPVS可能存在的不同的发病机制。颅外动脉粥样硬化狭窄(extracranial atherosclerosis,ECAS)可以造成EPVS加重。而颅内动脉粥样硬化狭窄(intracranial atherosclero-sis,ICAS)造成的穿支动脉供血不足及对血管内皮的损害可以对脑小血管病( cerebral small vesseldlscase,CSVD)的其他影像学标志物,如脑白质病(white matter lesion,WML)等产生影响,但目前暂无ICAS与EPVS的相关性研究。因此本研究旨在分析不同部位EPVS的危险因素以及不同部位EPVS与ICAS和ECAS的相关性,并进一步探讨不同部位EPVS形成的可能机制。
1资料与方法
1.1 研究对象 选取2016年1~12月华东医院神经内科病房收治入院的脑梗死患者72例,男性47例,女性25例,年龄37~89岁,平均年龄70. 61岁,其中≥65岁49例。患者已完善头颅MRI,至少包括T,WI、T-l WI及液体衰减翻转恢复序列,图像清晰,同时已完善脑血管及颈动脉磁共振血管造影或数字减影m管造影且数据记录完整。根据血管狭窄的部位将患者分为血管无狭窄( NS)组37例,男性26例,女性11例,平均年龄(70. 68±9.66)岁;ICAS组25例,男性13例,女性12例,平均年龄(69.12±12.13)岁;ECAS组患者10例,男性8例,女性2例,平均年龄( 74. 10±8.93)岁。排除标准:(1)头颅或血管MRI影像不清晰,或颅内陈旧性病灶影响EPVS观察及评分。(2)急性缺血性脑卒中,考虑T()AST分型心源性栓塞亚型。(3)患有其他可能导致血管狭窄的疾病,包括Moyamoya病、动静脉畸形、颈动脉夹层等。(4)混合型动脉狭窄。(5)数据记录不全者。
1.2 方法
1.2.1 资料采集 患者人院后,收集人组患者性别、年龄、高血压、糖尿病、吸烟、饮酒、冠心病病史等信息,以及人院后检测的实验室指标,包括血(:反应蛋白(C-reaction protein,CRP)水平和血脂指标(TC、T(J、I.DIJ、HDI.)等。
1.2.2 EPVS诊断及分级标准
将每例患者基底节区及脑白质区EPVS分为4级。分级标准:基底节区根据包含EPVS多的基底节层面中EPVS的数量分为:1级:<5个;2级:5~10个;3级:>10个,仍可计数;4级:不可计数。脑白质区:1级:所有脑白质层面中EPVS数量<10个;2级:所有脑白质层面中EPVS数量≥10个,但多的层面EPVS数量<10个;3级:包含EPVS多的脑白质层面中EPVS的数量为10~20个;4级:包含EPVS多的白质层面EPVS的数量>20个。本研究将EPVS分级>2级作为高分组,分级≤2级作为低分组9。。基底节区高分组18例和低分组54例;脑白质区高分组24例和低分组48例。
1.2.3 ICAS和ECAS分组标准
1CAS采用WAISD(Warfarin-Aspirin Symptomatic Intracranial Disease Trial)标准。ECAS采用NASCF.T(North American Symptomatic Carotid Endarterectomy Trial)标准。颅内动脉包括:椎动脉颅内段,基底动脉,颈内动脉颅内段,大脑中动脉,大腑前动脉和大脑后动脉;颅外动脉包括:颈总动脉、颈内动脉颅外段、椎动脉颅外段。ICAS和ECAS定义为血管狭窄>50%。
1.3统计学方法
采用stata 10软件进行统计分析,计量资料采用x±^表,多组比较采用单因素方差分析,正态分布且方差齐采用f检验,余采用Wilcoxon秩和检验,计数资料采用百分率表示,采用3[2检验,必要时行校正的X2检验或Fisher确切概率法,多因素logistic回归分析不同部位F:PVS的危险因素,P
2 结 果
2.1 3组临床资料比较
3组年龄,男性,高m压,糖尿病,吸烟,饮酒,冠心病比例以及TC、HDL和LDL水平比较,差异无统计学意义(P>0.05),3组CRP和T(J水平比较,差异有统计学意义(P<0.Ol,表1)。
2.2 基底节区EPVS不同级别危险因素比较
72例患者均发现基底节区EPVS,其中EPVS 1级37例,2级17例,3级11例,,l级7例。EPVS不同级别患者年龄≥65岁和饮酒比例比较,差异有统计学意义(P
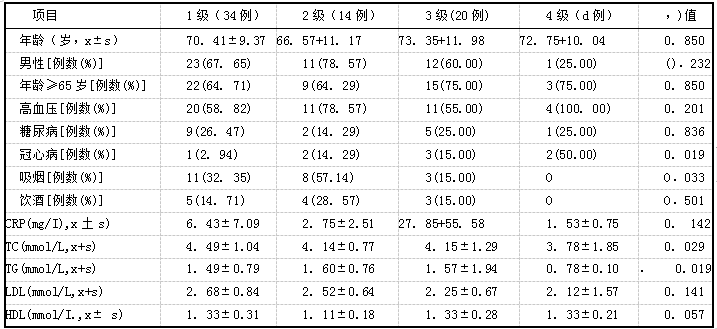
2.3脑白质区EPVS不同级别危险因素比较 脑白质区EPVS l级34例,2级14例,3级20例,4级4例,其不同级别患者冠心病和吸烟比例以及TC、TG水平比较,差异有统计学意义
表1 3组临床资料比较
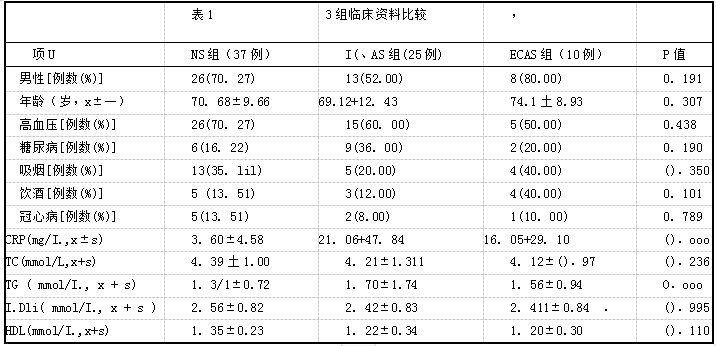
表2基底节区EPVS不同级别危险因素比较
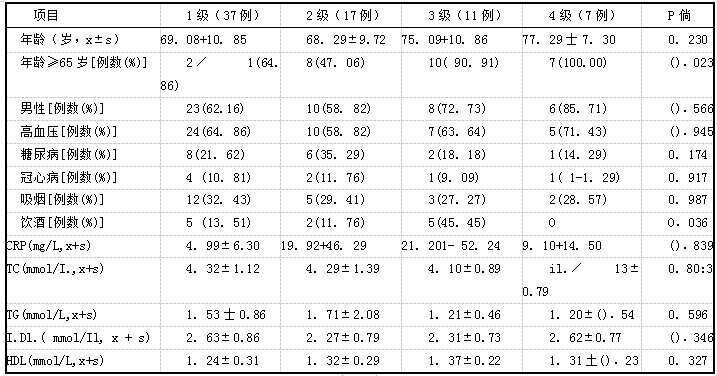
表3脑白质区EPVS不同级别危险因素比较
2.4基底节区和脑白质区不同程度EPVS危险因素比较基底节区高分组与低分组男性、高血、糖尿病、冠心病、吸烟和饮酒比例以及实验室指标比较,无统计学差异(P>O. 05),高分组年龄≥65岁比例明显高于低分组,差异有统计学意义(P=O. 006,表4)。脑白质区高分组冠心病比例高于低分组,TG水平明显低于低分组,差异有统计学意义(P<0. 05,表5)。对上述具有统计学意义的相关变量进一步行logistic多因素回归分析显示,冠心病(OR一5.95,95% CI:-0. 21~3. 70,P—0.080)和TG(OR一1. 01,95%CI: -0.40~0.420,P-0. 981)不是脑白质区严重EPVS的独立危险因素。
2.5 3组不同严重程度EPVS比例比较
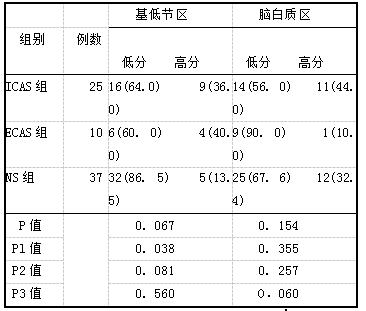
3组基底节区EPVS严重程度两两比较,ICAS组与NS组有显著差异(P=0.038);ECAS组与NS组虽无统计学差异,但ECAS组基底节区EPVS高分比例高于NS组(P=0.060);ECAS组与ICAS组无显著性差异(P=0.560)。3组脑白质区EPVS严重程度两两比较均无统计学差异(P>O. 05,表6)。
表4基底节区不同程度EPVS的危险因素分布
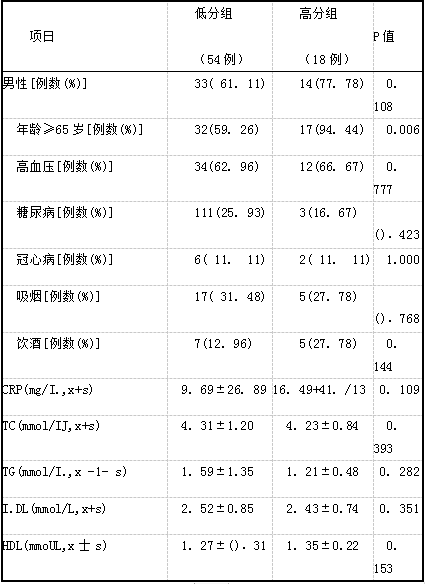
表5脑白质区不同程度EPVS的危险因素分布
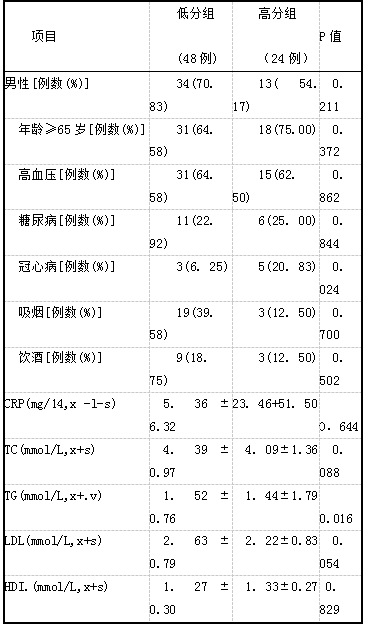
表6 3组不同严重程度EPVS比例比较[例数(%)]
2.6ICAS组和NS组基底节区不同严重程度
EPVS危险因素比较 2组基底节区EPVS高分组ICAS比例明显高于低分组(P<0.05),2组基底节区不同严重程度EPVS患者大脑中动脉(middle cerebral arteries,MCA)狭窄和MCA闭塞比例比较,差异无统计学意义(P>O. 05)。
3讨论
随着影像学技术的发展,EPVS逐渐被人们所重视,并认为其在认知功能障碍、多发性硬化及脑出血等多种疾病中预示着不同的病理改变圳。EPVS的确切机制尚不明确。Zhang等的研究认为,基底节区EPVS的严重性与高龄、WMI)的严重性等相关,脑白质区EPVS与性别(女性)、高血压等相关。Martinez-Ramirez等的研究也发现,基底节区严重的EPVS与高龄、高血压和严重的WML等相关,而皮质微出血是脑白质区严重EPVS的独立预测因素。脑内不同部位EPVS的危险因素不同,且不同部位的EPVS与疾病的相关性不同,说明不同部位的EPVS的临床意义及病理机制不同。
关于EPVS与血管狭窄的研究,Park等c 6]对78例具有单侧颈内动脉狭窄的患者进行了脑内双侧EPVS严重程度的差异性分析,结果显示,EPVS的严重程度与同侧ICAS的严重程度呈正相关。等口3也研究对比了29例严重单侧ICAS患者狭窄侧与对侧EPVS的严重程度,发现狭窄侧的基底节区EPVS数量与WMI。的严重性相关,可能与ICAS造成的慢性低灌注有关。Leung等的研究认为,MCA与基底动脉的狭窄和硬化引起管腔血流速度减慢,并阻碍了小深穿支的供血,造成了皮质及腔隙性脑梗死。此外,也有研究发现,ICAS而非ECAS导致了WML,这一影响有可能是通过穿支动脉的闭塞、分水岭区栓塞及血流动力学的影响发挥作用。但暂无ICAS与EPVS的相关性研究。为探讨不同部位EPVS危险因素及与ICAS和ECAS的相关性,本研究根据血管狭窄部位将患者分组,并将EPVS按部位分l~4级。结果显示,年龄≥65岁、ICAS患者基底节区EPVS较NS及ECAS患者更为严重;冠心病及TG升高与脑白质区严重EPVS相关;脑白质区EPVS严重性与脑血管狭窄的有无及部位无明显相关性。随年龄变化,脑内不同区域小血管的脂质透明样变、透明纤维增厚及淀粉样血管病变的严重程度不同。导致血管壁的通透性及血管周围间隙在脑内不同区域具有差异性。因此,不同区域的EPVS可能具有不同的小血管病理改变。年龄是脑淀粉样血管病的重要危险因素。高血压是小动脉硬化、纤维素样坏死及脂质透明样变的主要原因。这可能是导致不同区域EPVS的危险因素不同的原因。其次,血脑屏障、血管周围间隙及脑脊液都可以作为脑实质排出代谢废物的通路。而血管内皮通透性随年龄增长而增高。因此,年龄增长可以破坏血管内皮的完整性,从而影响脑代谢废物的排出,使得EPVS。基底节区较严重的EPVS多见于ICAS组的原因可能为:(1)小动脉硬化可导致EPVScl1。虽然小血管疾病与大动脉粥样硬化在病理上存在一定差异,但本质上均为血管内皮改变及炎性反应。基底节区的血液供应来自于MCA的深穿支豆纹动脉,MCA的粥样硬化性斑块可以阻塞豆纹动脉的开口。MCA狭窄远端的低血流、低灌注同样影响穿支动脉的血流供应。(2)动脉粥样硬化引起的炎性反应及全身血管内皮功能障碍,可引起血脑屏障通透性增高,导致血管内物质排出增多而引起EPVS。(3)既往研究证实,ICAS的危险因素吸烟、高血压等在EPVS的病理改变中同样发挥重要作用。
综上所述,严重ICAS患者更易出现基底节区严重的EPVS。但本研究仍然存在不足之处:(1)排除了数据记录不全及混合型狭窄的患者,使样本量较小。(2)EPVS按部位计数分级易导致“天花板效应”。(3)未细化血管狭窄的数目、严重程度,且未区分EPVS的狭窄侧与非狭窄侧。尚需通过更大样本的研究,探究单支及多支不同程度ICAS对基底节区EPVS的影响。
-
论文打印要求是什么,单面还是双面? 132410
-
ieee论文什么水平,含金量如何? 71529
-
医学检验期刊有哪些?论文发表难吗? 2019.11.15 17:25
-
医药卫生省级期刊发表的要求以及投稿渠道 2019.11.15 16:32
-
预防医学核心期刊发表的经验 2019.11.15 15:26
-
中国内镜杂志期刊发表的投稿要求 2019.11.15 14:32