新辅助化疗在局部晚期子宫颈癌中的疗效观察
新辅助化疗在局部晚期子宫颈癌中的疗效观察
刘莹 张红平 杨宏英 王高伟
【摘要】目的对比新辅助化疗( neoadjuvant chemotherapy,NACT)后再行宫颈癌根治术与直接手术在局部晚期宫颈癌患者中的疗效,以寻找治疗局部晚期官颈癌的佳方案。方法回顾性分析2010年1月至2015年7月在云南省肿瘤医院确诊为“局部晚期宫颈癌(IB2、ⅡA2期)”的患者512例,其中242例直接行“宫颈癌根治术”,270例先行新辅助化疗2程后再行“宫颈癌根治术”。从多方面综合分析两种治疗方式的差异。结果新辅助化疗可以明显缩小局部晚期宫颈癌患者的肿瘤直径(P<0.05)。两组患者的术中出血量、手术消耗间、术后尿瘘的发生率差异无统计学意义(P>0.05)。两组患者的淋巴结阳性率、阴道切缘阳性率、官旁阳性率及深肌层受侵率差异无统计学意义(P>0.05),但是脉管阳性率有显著的统计学差异(P<0.05)。两组患者术后需补充治疗比率差异有统计学意义(P<0.05)。两组患者的生存情况差异无统计学意义(P>0.05)。结论对于局部晚期宫颈癌来说,新辅助化疗是术前缩小肿瘤的一种安全、有效的方式;新辅助化疗并不能降低手术难度及术后尿瘘的发生率,但是降低了术后病理的脉管阳性率;接受了新辅助化疗的患者术后更多的接受了放、化疗等多重治疗;新辅助化疗不能改善患者的生存情况。
【关键词】局部晚期官颈癌;新辅助化疗;宫颈癌根治术;病理特征;生存情况
doi:10 .13 390/j .issn.1672-1861.2018 .05 .007
作者单位:650118云南省肿瘤医院妇科(昆明医科大学第三附属医院妇科、云南省妇科肿瘤临床研究中心、云南省妇科省级重点专科)
通信作者:王高伟Email: 1479496266@qq.com
随着官颈癌筛查在全世界范围内的普及,官颈癌的发病率和死亡率在世界范围内明显下降,但是在中国宫颈癌的发病率不降反升且有年轻化趋势。对于该类型的患者NCCN指南(美国国家综合癌症网络,National Comprehensive Cancer Network)推荐直接行根治性放疗口1。本研究回顾性分析了270例先行新辅助化疗( neoadjuvant chemotherapy,NACT)和242例直接行手术治疗的局部晚期宫颈癌( locally advanced cervical comcer,LACC)患者的临床、病理、治疗、预后等方面的资料。为NACT在LACC患者中的应用提供循证医学证据。
材料与方法
一、临床资料
2010年1月至2015年7月在云南省肿瘤医院诊断为“官颈癌I B2、ⅡA2期”的患者512例,其中242例患者直接行“宫颈癌根治术( radicalhysterectomy,RH)”称为RH组,270例患者先行NACT 2个疗程后再行官颈癌根治术,称为NACT组。512例患者符合:①患者平均年龄( 52.4±7.58)岁;②病理类型为鳞癌、腺癌、腺鳞癌,不包括小细胞神经内分泌癌、透明细胞癌等特殊和少见的病理类型;③所有患者接受的是“经腹的根治性子宫切除+盆腔淋巴结清扫术±腹主动脉旁淋巴结切除或取样。
二、方法
新辅助化疗方案:紫杉醇175 mg/m2第1天静脉点滴+顺铂75 mg/m2分2~3 d静脉点滴,根据肿瘤消退情况行化疗1~2程后再行手术治疗。对两组患者的基本资料、肿瘤的基本情况、手术情况、术后输尿管膀胱阴道瘘情况、术后病理特征、术后补充治疗情况、以及生存情况进行对比分析。
三、统计学处理
采用SPSS 24.0软件进行统计学分析。计量资料以“均数±标准差(i±s)”表示,采用f检验;非连续变量资料进行卡方检验。以P<0.05为差异有统计学意义。
结 果
一、NACT组的近期疗效分析
在270例患者中,NACT的总有效率为72.22%,无一例发生进展。在186例I B2患者中,其中有18例完全缓解( CR),69例病情稳定( SD),其余患者均为部分缓解(PR)。与84例ⅡA2期患者相比,以上各指标的比率相当,差异无统计学意义(P>0.05);NACT组与RH组的手术时间、术中出血量相当,差异无统计学意义(P>0.05)。术后膀胱和输尿管瘘的发生率NACT组较高,但差异无统计学意义(JP>0.05)。
二、两组患者术后病理危险因素分析
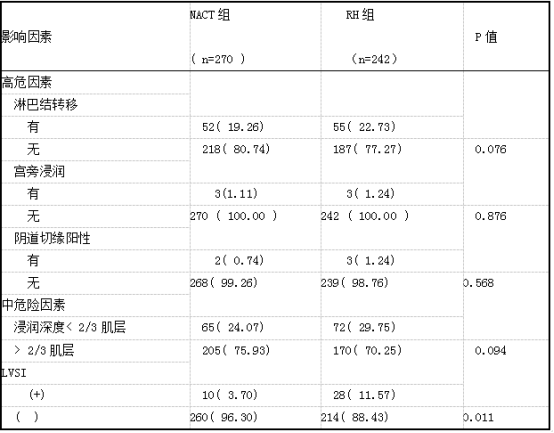
本研究结果显示,NACT组与RH组术后病理的淋巴结转移率、阴道切缘阳性率、宫旁浸润率差异无统计学意义(P>0.05),而淋巴血管间隙(lympho-vascular space involvement, LVSI) 阳性率差异有统计学意义(P<0.05),见表l。
表1 两组患者的病理特征分析[例(%)]
三、补充治疗的情况
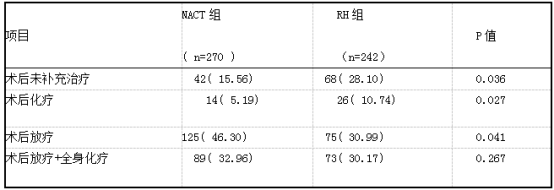
本研究结果显示,LACC患者术后补充后续治疗的比例为78.52%,其中7.81%的患者补充了全身化疗、39.06%的患者补充了放疗、31.64u/o的患者补充了“放疗+全身化疗”。与RH组相比,NACT组的患者更多的接受了后续治疗,差异有统计学意义(P<0.05)。在术后需要补充后续治疗的患者中,NACT组患者更多的补充了放疗,而RH组患者更多的补充了单纯化疗,差异有统计学意义(P<005)。
两组患者术后补充“放疗+全身化疗”的比例相当,差异无统计学意义(P>005),见表2。
表2两组患者术后补充治疗的情况[例(%)]
四、随访情况
在纳入分析的512名患者中,所有患者均完成了2年的随访,其中有192名患者完成了5年的随访(部分患者随访时间还未满5年),随访结果如下:LACC患者治疗后两年总生存(OS)率为:92.19%,无进展生存(PFS)率为:80.860/0。治疗后5年总生存( OS)率为:81.77%,无进展生存( PFS)率为:72.40u/o。接受NACT的患者治疗后2、5年的OS和PFS与RH组相比差异均无统计学意义(P>0.05)。
讨 论
NACT是指在实施手术前所做的全身化疗,明确的目的就是缩小肿瘤,增加手术切除率。Vizza等的研究显示NACT可以明显降低术中出血量。本研究结果则显示NACT可以明显缩小LACC患者肿瘤的体积,但是两组的手术时间、术中出血量、术后尿瘘的发生率相当。究其原因我们认为除了肿瘤本身外,患者的一般情况、免疫状态、手术医生的熟练程度等都是不可控的因素,因此不同的观察对象可能会出现不同的结果。
近年来已有多位学者研究了NACT对术后病理危险因素的影响,研究结果也不尽相同。Peng等的研究显示NACT可以显著降低术后病理危险因素出现的比例。庄晴晴等的研究发现NACT可以显著降低术后淋巴结转移率及术后辅助治疗率。而我们的研究发现NACT不影响淋巴结转移率、切缘阳性率、宫旁浸润率等病理高危因素,但是降低了淋巴脉管侵袭率,这与其他学者的研究亦存在差异。我们分析认为,NACT如果可以降低术后高危因素的出现比例,则会使临床医生对术后危险因素低估,导致术后补充治疗不足。但是我们的研究结果却显示,接受NACT后的患者术后补充治疗的比例很高。这说明临床医生在评估术后治疗时已经意识到NACT可能会影响术后病理的准确性,适当的放宽了术后补充治疗的指征。我们的研究结果提示NACT并不影响术后高危病理因素的阳性率,因此理论上讲就不应该会影响临床医师对术后补充治疗的评估。但是,它降低了淋巴脉管侵袭率。有学者认为,LACC本身就存在术后复发、转移的风险,术后均应补充放化疗。因此,在没有明确补充治疗的指征下多数医生可能会考虑术后辅助放化疗。综合分析目前的各项研究,NACT可能会对宫颈癌患者术后病理危险因素产生不同程度的影响,使其不能反应肿瘤的真实情况,从而影响临床医生对术后补充治疗的评估。从我们的观察结果来看,多数接受过NACT的患者术后均补充了放化疗。
后,我们对这些患者进行了生存分析发现,NACT并不能提高患者的OS和PFS。这与近期两个多病例的对照研究结果相似喁1。我们分析认为,官颈癌主要以局部浸润和区域淋巴结转移为主,因此放疗和手术是其重要的治疗方式,化疗从未担任过主角。而且术前仅行1~2疗程,因此对患者的预后影响不大。
综合上述,我们认为NACT用于LACC的治疗虽然可以不同程度的缩小肿瘤体积,,但是与RH相比并没有明显的降低手术难度。同时它可能对术后的病理特征产生不同程度的影响,这对于判断术后补充治疗是不利的。接受过NACT的患者更多的重复遭受了手术、放疗、化疗这三种治疗方式,这在卫生经济学方面也是不利的。同时我们发现接受了这些治疗并不会改善患者的生存。因此,我们认为NACT与直接RH相比不具备明显的优势,不应作为治疗LACC的常规治疗方式。当然,需要我们进一步长期、多中心、多样本的观察。
参考文献
[1]. Mining L,Patrono MG, Romero N, et al. different strategies of treatment for uterine cervical carcinoma stage I B2~ 11 B[J]. World J Clin Oncol, 2014, 52:86-92.
[2] National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology: CervicalCancer, Versionl [EB/OL].2018.Available at http://www.nccn.org/professionals/physician_ gls/pdf/cervical. pdf. Accessed November 7, 2015.
[3] Raspagliesi F, Ditto A, Selvaggi L,et al.A phase 2 multicenter study of irinotecan and cisplatinum as neoadjuvant treatment in patients with locally advanced cervical cancer[Jl. Int J Gynecol cancer, 2010, 20:1569-1575.
[4] Vizza E,Pellegrino A, Milani R,et al.Total laparoscopicradi cal hysterectomy and pelvic lymphadenectomy in locally advanced stage IB2-IIB cervical cancer patients after neoadjuvant chemotherapy[J]. Eur J Surg Oncol, 2011, 37:364-369.
[5]Peng YH, Wang XX, Zhu JS, et al.Neo-adjuvant chemotherapy plus surgery versus surgery alone for cervical cancer: Metaanalysis of randomized controlled trials [J].J Obstet GynaecolRes, 2016, 42(2):128-135.
[6] 庄晴晴,王常玉.新辅助化疗与单纯手术在局部晚期官颈癌患者中的疗效对比分析[J].现代妇产科进展,2016,25(7):487-490.
[7] Moioli M, Papadia A, Mammoliti S,et al_Chemotherapy with cisplatin and paclitaxel in locally advanced cervical cancer: has this regimen still a role as neoaduvant setting?[J]. Minerva Ginecol, 2012, 64:95-107.
[8] Kim HS, Sardi JE, Katsumata N, et al.Efficacy of neoadjuvant chemotherapy in patients with FIGO stage I Bl to a cervical cancer: an international collaborative meta-analysis[J]. Eur J Surg Oncol, 2013, 39:115-124.
-
论文打印要求是什么,单面还是双面? 132289
-
ieee论文什么水平,含金量如何? 71478
-
医学检验期刊有哪些?论文发表难吗? 2019.11.15 17:25
-
医药卫生省级期刊发表的要求以及投稿渠道 2019.11.15 16:32
-
预防医学核心期刊发表的经验 2019.11.15 15:26
-
中国内镜杂志期刊发表的投稿要求 2019.11.15 14:32