第二节:Western Blot结果条带问题的全面分析
Western Blot 结果条带问题1、什么也没有
出现原因:比较多,如果单纯一张没有任何显色的 X 光片,可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。
解决办法:仔细检查抗体是否加错,确认转膜没有问题。
经验:上面的图片展示的是一点信号都没有,如果是这样大部分情况是抗体加错了。如果中间出现了细微的条带,可能原因是蛋白上样量太少,一抗浓度过低, ECL发光液失效。另外如果转膜出现了问题,比如膜放反了,自然是一个白片。
Western Blot 结果条带问题2、高背景
出现原因:封闭不够好,一抗浓度高,洗膜时间和次数不够
解决办法:降低一抗浓度,增加洗膜时间和次数。
经验:高背景可能是 WB 中常见出现的问题,目的条带单一清晰,但是其他地方又弥漫性较为均一的背景 (比较连续的) 。其实只要我们注意操作规范, 不偷工减料就很容易避免, 洗膜按照规定来 5min*5 次或者 10min*3 次,不要改成 5min*3 次,或者 10min*2 次 。
Western Blot 结果条带问题3、特异性条带
出现原因:一抗非特异性与蛋白结合
解决办法:更换一抗
经验:此种情况绝大多数是因为一抗不好,你无法判断那一条是目的条带。如果实在没有更好的抗体, 建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。 当然这种情况下有一种很小几率的可能是一抗浓度太高引起的非特异性结合。
Western Blot 结果条带问题4、条带中出现边缘规则的白圈
出现原因:电转中膜和胶之间存在气泡。[解决办法 ]:转膜前去掉膜和胶之间的气泡
经验:我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,好的高度是与放上第一层滤纸齐平, 然后往滤纸上浇点转膜液, 把电泳胶用清水清洗下, 将电泳胶平铺到滤纸上, 仔细检查滤纸与胶之间是否有气泡, 可以左右前后观察, 不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住 PVDF膜的两侧中间,使膜成 U 型,然后将 U 型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。然后上层滤纸同样用 U 型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。注意不要来回赶气泡,这样反而会带入气泡。
Western Blot 结果条带问题5、带中间出现白色(反白)
原因 :中心部位高浓度 HRP把底物消耗过快,中间部位底物消耗结束之后就不发光了
解决办法 :降低蛋白量,降低一抗和二抗的浓度。
经验 :如果你足够迅速,可以在中间部位底物消耗之前就把 X 光片给定影出来,但是时间很难把握,建议还是从降低蛋白量,降低一抗二抗浓度入手。
Western Blot 结果条带问题6、出现黑点和黑斑
出现原因 :膜上其他部位与一抗或者二抗非特异性结合
解决办法 :封闭牛奶一定要纯,封闭结束之后要洗
经验:我们常常是等到要封闭的时候发现没有牛奶,然后匆匆忙忙用 PBST/TBST配置,配的匆忙的时候往往不管是否已经完全溶解, 如果没有完全溶解的情况下加牛奶倒膜上, 会导致很多不溶性颗粒附着在膜上, 这就会导致发光时候膜上的黑点。 所以牛奶溶解之后, 好静止一下,然后轻轻地吸取上层牛奶进行封闭,封闭结束之后一定要洗三遍之后再加一抗。
Western Blot 结果条带问题7、条带拖尾
出现原因:蛋白量太大,一抗浓度和时间太长
解决办法:根据情况调整蛋白量,同时一抗浓度和时间也可以缩短。
经验:这种情况很容易出现,因为很多原因都可能导致这一个结果。一般来说,蛋白量都是我们经过很多次摸索得出的适蛋白量, 因此不太可能是蛋白量过多引起的。 有可能的是因为一抗浓度太高, 作用时间太长引起的。 另外洗一抗和洗二抗千万不要偷工减漏, 建议5min*5 次,不要但是洗这么多次就把抗体和蛋白洗掉了,你又不是拿刀在上面刮,真正的抗原抗体的结合是通过这种方式洗不掉的。
Western Blot 结果条带问题8、 出现重影
出现原因:荧光强度比较高,在压片时,放好之后不小心又轻微移动了一段距离
解决办法: X 光片放上去之后,就不要动了,即使放歪了也没关系。
经验:有的时候出现重新刚好在上下位置,并且重影会相对弱一些,不要误以为抗体识别了该蛋白的另外一种异构形式。
Western Blot 结果条带问题9、出现非均一性背景
出现原因 :膜可能曾经干过
解决办法:在每一步的操作过程中,都需要注意不要让膜干
经验:在封闭的时候, 洗一抗, 洗二抗, 以及发光的时候都时刻需要注意蛋白面不要风干, 风干之后结果很可能就是这个样子。注意与高背景区别。
Western Blot 结果条带问题10、条带变形
出现原因: SDSPAGE胶中存在气泡或者某不溶性颗粒
解决办法:配胶过程中要小心,使用无杂质的液体。
经验:很多实验室中使用的不是新的设备, 比如配胶用的海绵垫, 如果用了很多年之后, 会从下面往上面漏小气泡, 当气泡足够小并且胶快凝固的时候, 走到中间的小气泡就停留在胶内,并会影响到后面的跑胶。另外配胶用的水, SDS, Tris 缓冲液要注意不要有杂质。
Western Blot 结果条带问题11、带呈哑铃状
出现原因:配置胶有问题
解决办法:把胶配好,不合格的胶坚决不用
经验:出现哑铃大的可能是胶没有配置好,胶凝固后不均一,不知道大家有没有出现如下的配胶情况, 下图中示意拔完梳子之后的结果, 如果你拔完梳子之后出现图中下面部分的样子, 多半会出现哑铃状。另外还有一种可能是样品中含有太多杂质, 没有离心下来, 然后杂质沉积在孔的中间,蛋白自然被推挤到两边。
Western Blot 结果条带问题12、缘条带弯曲
出现原因:电泳电流不均一
解决办法:换用新的电泳槽; 不使用两边的两孔
经验:一般我们使用的是 10 孔的的胶,如果你上样刚好 10 个孔,那么两头的两个孔肯定会歪曲。另外上样好在胶的中间,这样电场均一。
Western Blot 结果条带问题13、过程中出现现象及问题
(1) 整个条带呈 “︶ ”状:凝胶冷却不均一,电泳槽老化。
(2) 整个条带呈 “︵ ”: 凝胶左右两头没有凝固好
(3) 溴酚蓝拖尾:样品溶解不好。
(4) 纵向的纹理:上样样品中存在不溶性颗粒
(5) 溴酚蓝很粗:浓缩胶浓缩效果不好,可能是浓缩胶太短,或者是浓缩胶配错。
(6) 在分离胶中跑不动: Tris-Cl PH值不对,或者忘记加 SDS。
Western Blot 结果条带问题14、其他
(1) 蛋白分子量偏高或者偏低。可能是胶的浓度与目的蛋白的浓度不对应,比如说 100KD的蛋白你用 12%的胶跑,或者说 20KD 的蛋白你用 6%的胶跑。
(2) 蛋白质降解。蛋白质降解后很可能会在比原来位置低的地方出现主带,然后会出现一些其他带,主要特点是所有的条带比正常的都低,并且条带模糊不清晰。
(3) 所有条带连成一片没有间隔。原因可能是上样量过多,其次是样品弥散(比如电泳长时间停止样品弥散)。
-
论文打印要求是什么,单面还是双面? 132264
-
ieee论文什么水平,含金量如何? 71466
-
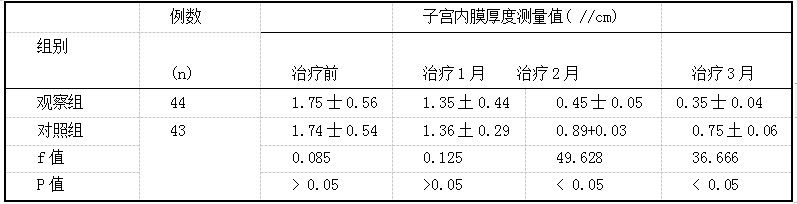
左炔诺孕酮不同给药途径对患者子宫内膜增生症的临床疗效评价 2019.10.30 15:05
-
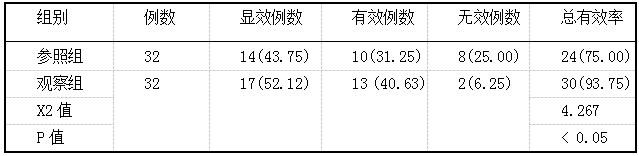
胸腺肽与恩替卡韦联用对患者原发性肝癌的临床疗效及其对预后的影响 2019.10.30 14:47
-
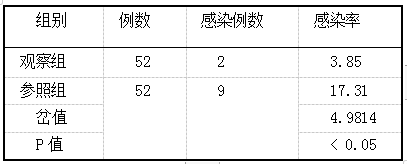
甲硝唑片官腔置入与左氧氟沙星口服对人工流产患者术后抗感染的临床疗效评价 2019.10.30 14:28
-
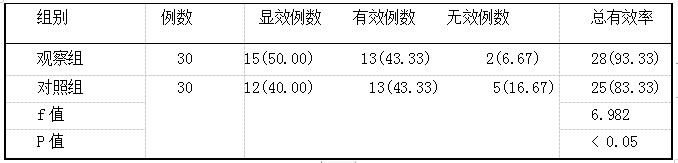
瑞舒伐他汀与常规降压药物联用对反勺型高血压患者降压疗效的影响 2019.10.30 11:35
-
 DNA的琼脂糖凝胶电泳实验原理和步骤
DNA的琼脂糖凝胶电泳实验原理和步骤 -
提取RNA及用DEPC去除RNase的实验经验
-
 医学生物学电子显微镜图谱
医学生物学电子显微镜图谱 -
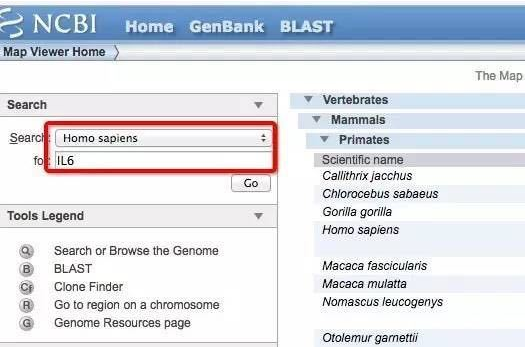 如何使用 NCBI 查找基因序列、mRNA和Promoter
如何使用 NCBI 查找基因序列、mRNA和Promoter