PCR实验操作步骤
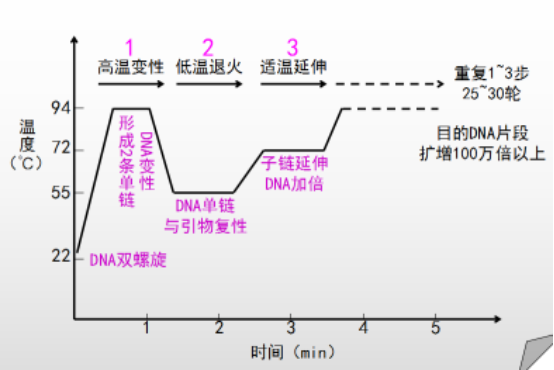
PCR实验操作原理:将待扩增的模板DNA置高温下(通常为93℃-94℃)使其变性解成单链;人工合成的两个寡核苷酸引物在其合适的复性温度下分别与目的基因两侧的两条单链互补结合,两个引物在模板上结合的位置决定了扩增片段的长短;耐热的DNA聚合酶(Taq酶)在72℃将单核苷酸从引物的3’端开始掺入,以目的基因为模板从5’→3’方向延伸,合成DNA的新互补链。
PCR实验材料:
(1)DNA模版
(2)对应目的基因的特异引物
(3)10×PCR Buffer
(4)2mM dNTPmix:含dATP、dCTP、dGTP、dTTP各2mM
(5)Taq酶
PCR实验操作步骤:
1、在冰浴中,按以下次序将各成分加入一无菌0.5ml离心管中。
10×PCR buffer
5 μl dNTP mix (2mM)
4 μl 引物1(10pM)
2 μl 引物2(10pM)
2 μl Taq酶 (2U/μl)
1 μl DNA模板(50ng-1μg/μl)
1 μl 加ddH2O至 50 μl
视PCR仪有无热盖,不加或添加石蜡油。
2、调整好反应程序。将上述混合液稍加离心,立即置PCR仪上,执行扩增。一般:在93℃预变性3-5min,进入循环扩增阶段:93℃ 40s → 58℃ 30s → 72℃ 60s,循环30-35次,后在72℃ 保温7min。
3、结束反应,PCR产物放置于4℃待电泳检测或-20℃长期保存。
4、PCR的电泳检测:如在反应管中加有石蜡油,需用100μl氯仿进行抽提反应混合液,以除去石蜡油;否则,直接取5-10μl电泳检测。
PCR实验操作注意事项:
1、PCR反应应该在一个没有DNA污染的干净环境中进行。好设立一个专用的PCR实验室。
2、所有试剂都应该没有核酸和核酸酶的污染。操作过程中均应戴手套。
3、PCR试剂配制应使用高质量的新鲜双蒸水,采用0.22μm滤膜过滤除菌或高压灭菌。
4、试剂都应该以大体积配制,试验一下是否满意,然后分装成仅够一次使用的量储存,从而确保实验与实验之间的连续性。
5、试剂或样品准备过程中都要使用一次性灭菌的塑料瓶和管子,玻璃器皿应洗涤干净并高压灭菌。
6、PCR的样品应在冰浴上化开,并且要充分混匀。
7、纯化模板所选用的方法对污染的风险有极大影响。一般而言,只要能够得到可靠的结果,纯化的方法越简单越好。
以上就是关于PCR实验操作步骤的详细介绍,希望可以帮到大家。本站会持续发布有关实验技术方面的实验技巧,供大家参考学习,敬请期待!
-
论文打印要求是什么,单面还是双面? 132182
-
ieee论文什么水平,含金量如何? 71428
-
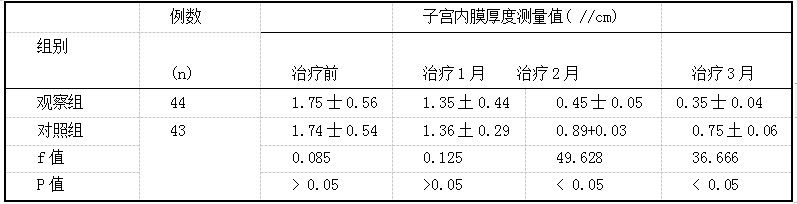
左炔诺孕酮不同给药途径对患者子宫内膜增生症的临床疗效评价 2019.10.30 15:05
-
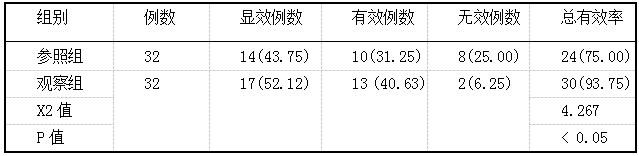
胸腺肽与恩替卡韦联用对患者原发性肝癌的临床疗效及其对预后的影响 2019.10.30 14:47
-
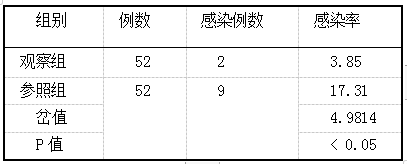
甲硝唑片官腔置入与左氧氟沙星口服对人工流产患者术后抗感染的临床疗效评价 2019.10.30 14:28
-
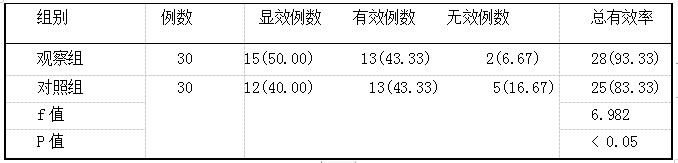
瑞舒伐他汀与常规降压药物联用对反勺型高血压患者降压疗效的影响 2019.10.30 11:35
-
 DNA的琼脂糖凝胶电泳实验原理和步骤
DNA的琼脂糖凝胶电泳实验原理和步骤 -
提取RNA及用DEPC去除RNase的实验经验
-
 医学生物学电子显微镜图谱
医学生物学电子显微镜图谱 -
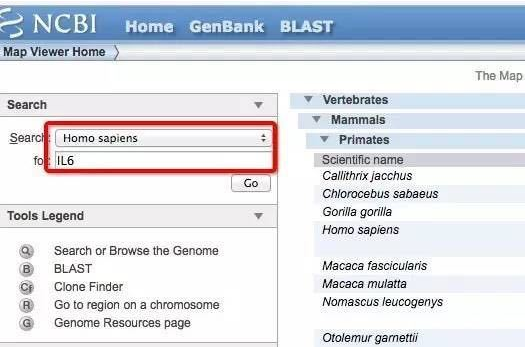 如何使用 NCBI 查找基因序列、mRNA和Promoter
如何使用 NCBI 查找基因序列、mRNA和Promoter